A. TUJUAN
B.ALAT DAN BAHAN
Alat
Alat
1. Sensor Gas MQ-7
Sensor ini biasanya digunakan untuk mendeteksi gas Kabrbon Monoksida (CO)
Bahan
2. Buzzer DC
Buzzer digunakan sebagai indikator bahwa proses telah selesai atau terjadi suatu kesalahan pada sebuah alat (alarm).
24.1 Kelas Senyawa Organik
Karbon dapat membentuk lebih banyak senyawa daripada unsur lainnya karena atom karbon tidak hanya dapat membentuk ikatan karbon-karbon tunggal, ganda, dan rangkap tiga, tetapi juga untuk saling terhubung dalam rantai dan struktur cincin. Cabang ilmu kimia yang berhubungan dengan senyawa karbon adalah kimia organik. Golongan senyawa organik dapat dibedakan menurut gugus fungsi yang dikandungnya. Gugus fungsional adalah sekumpulan atom yang sebagian besar bertanggung jawab atas perilaku kimiawi molekul induk. Molekul berbeda yang mengandung jenis gugus atau gugus fungsi yang sama mengalami reaksi yang serupa. Sebagian besar senyawa organik diturunkan dari sekelompok senyawa yang dikenal sebagai hidrokarbon karena hanya terdiri dari hidrogen dan karbon. Berdasarkan strukturnya, hidrokarbon dibagi menjadi dua kelas utama — alifatik dan aromatik. Hidrokarbon alifatik tidak mengandung gugus benzen, atau cincin benzen, sedangkan hidrokarbon aromatik mengandung satu atau lebih cincin benzen.
24.2 Hidrokarbon Alifatik
Alkana memiliki rumus umum CnH2n+2, dimana n = 1, 2, 3, 4, . . . Karakteristik penting dari molekul hidrokarbon alkana adalah hanya terdapat ikatan kovalen tunggal. Alkana dikenal sebagai hidrokarbon jenuh karena mengandung jumlah maksimum atom hidrogen yang dapat terikat dengan jumlah atom karbon yang ada. Alkana yang paling sederhana (yaitu, dengan n = 1) adalah metana CH4, yang merupakan produk alami dari penguraian bakteri anaerobik pada materi nabati di bawah air. Karena pertama kali dikumpulkan di rawa-rawa, metana dikenal sebagai "gas rawa". Secara komersial, metana diperoleh dari gas alam. Gambar 24.2 menunjukkan struktur dari dari rumus deret alkana. Gas alam adalah campuran metana, etana, dan sejumlah kecil propana. Alkana seperti isomer struktural butana digambarkan memiliki struktur rantai lurus atau rantai bercabang. n-Butana adalah alkana rantai lurus karena atom karbonnya tergabung dalam satu garis. Dalam deret alkana, dengan meningkatnya jumlah atom karbon, jumlah isomer struktur meningkat dengan cepat. Misalnya, butana, C4H10, memiliki dua isomer; decane, C10H22, memiliki 75 isomer; dan alkana C30H62 memiliki lebih dari 400 juta.
Nomenklatur Alkana
Nomenklatur alkana dan semua senyawa organik lainnya didasarkan pada rekomendasi dari International Union of Pure and Applied Chemistry (IUPAC). Empat alkana pertama (metana, etana, propana, dan butana) memiliki nama nonsistematis, jumlah atom karbon tercermin dalam prefiks Yunani untuk alkana yang mengandung lima hingga sepuluh karbon. Sekarang menerapkan aturan IUPAC untuk contoh berikut:
1. Nama induk hidrokarbon adalah yang diberikan pada rantai atom karbon terpanjang dalam molekul. Jadi, nama induk dari senyawa berikut ini adalah heptana karena terdapat tujuh atom karbon pada rantai terpanjang.
2. Alkana dengan atom hidrogen yang kurang satu adalah gugus alkil. Misalnya, ketika atom hidrogen dikeluarkan dari metana, kita memiliki fragmen CH3, yang disebut gugus metil. Demikian pula, menghilangkan atom hidrogen dari molekul etana menghasilkan gugus etil, atau C2H5.
3. Ketika satu atau lebih atom hidrogen diganti dengan kelompok lain, nama senyawa harus menunjukkan lokasi atom karbon tempat penggantian dilakukan. Prosedurnya adalah memberi nomor pada setiap atom karbon pada rantai terpanjang ke arah yang memberikan nomor yang lebih kecil untuk lokasi semua cabang.
4. Jika terdapat lebih dari satu cabang alkil dari jenis yang sama, kita menggunakan awalan seperti di-, tri-, atau tetra- dengan nama gugus alkil.
5. Alkana dapat memiliki banyak jenis substituen.
soal :
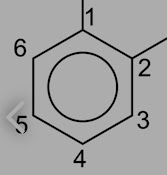
Berikan nama pada rantai karbon berikut ini:
Langkah pertamanya, Menentukan rantai Terpanjang:
Langkah kedua, beri nomor rantai utama (rantai terpanjang), berdasarkan ujung yang paling dekat dengan cabang/gugus fungsi.
1. Pada soal (a), Penomoran dilakukan dari karbon yang dibawah, karena posisi itu lebih dekat dengan cabang. Cabang terdapat pada karbon nomor 3, dan jenis cabangnya ialah Metil, Maka nama senyawa hidrokarbon ini ialah: 3, Metil heksana
2. Pada soal (b), Penomoran dilakukan dari karbon yang atas, karena posisi itu lebih dekat dengan cabang. Cabang terdapat pada karbon nomor 3, dan jenis cabangnya ialah Etil, Maka nama senyawa hidrokarbon ini ialah: 3, Etil heptana
Untuk Rantai Karbon dengan Dua Atau lebih Cabang
1. Jika terdapat 2 cabang yang sama maka berikan nama (di-) jika 3 (tri-), 4 (tetra-), lima (penta-) dst.
2. Jika terdapat 2 atau lebih cabang berbeda, maka namanya dituliskan berurutan sesuai abjad. Pengurutan ini tidak menyertakan tambahan di-, tri-, tetra-, dst, tetapi memasukkan iso- dan neo-.
Reaksi Alkana
Alkana umumnya tidak dianggap zat yang sangat reaktif. Namun, dalam kondisi yang sesuai, mereka bereaksi. Misalnya, gas alam, bensin, dan bahan bakar minyak adalah alkana yang mengalami reaksi pembakaran yang sangat eksotermis.
Halogenasi alkana — yaitu, penggantian satu atau lebih atom hidrogen oleh atom halogen — adalah jenis reaksi lain yang dialami alkana. Ketika campuran metana dan klorin dipanaskan di atas 100 ° C atau diiradiasi dengan cahaya dengan panjang gelombang yang sesuai, dihasilkan metil klorida.
contoh soal : Apa yang dimaksud dengan rumus alkil? berikan contoh!
= Alkil adalah senyawa alkana yang melepaskan satu atom H nya untuk bisa berkaitan dengan senyawa lain. contoh CH3 (metil) dan C2H5 (etil)
Isomer Optik Alkana Tersubstitusi
Isomer optik adalah senyawa yang merupakan bayangan cermin nonsuperimposable satu sama lain. Gambar 24.3 menunjukkan gambar perspektif dari methan tersubstitusi CH2ClBr dan CHFClBr dan bayangan cerminnya. Gambar cermin CH2ClBr superimposable tetapi CHFClBr tidak. Jadi, molekul CHFClBr adalah kiral. Sebagian besar molekul kiral sederhana mengandung setidaknya satu atom karbon asimetris — yaitu, atom karbon yang terikat pada empat atom atau kelompok atom yang berbeda.
Sikloalkana
Alkana yang atom karbonnya tergabung dalam cincin dikenal sebagai sikloalkana. Mereka memiliki rumus umum CnH2n, di mana n = 3, 4,. . . . Sikloalkana yang paling sederhana adalah siklopropana, C3H6 (Gambar 24.4). Analisis teoritis menunjukkan bahwa sikloheksana dapat mengasumsikan dua geometri berbeda yang relatif bebas regangan (Gambar 24.5). Yang kami maksud dengan "regangan" adalah bahwa ikatan dikompresi, diregangkan, atau diputar keluar dari bentuk geometris normal seperti yang diprediksi oleh hibridisasi sp3. Geometri paling stabil adalah bentuk kursi.
Gambar 24.4 Struktur empat sikloalkana pertama dan bentuknya yang disederhanakan.
Gambar 24.5 Molekul sikloheksana bisa eksis dalam berbagai bentuk. Bentuk yang paling stabil adalah bentuk kursi dan yang kurang stabil adalah bentuk perahu. Dua jenis atom H masing-masing diberi label aksial dan ekuator.
Alkynes
Alkuna mengandung setidaknya satu ikatan rangkap tiga karbon-karbon. Mereka memiliki rumus umum CnH2n-2, di mana n = 2, 3,. . .
Nomenklatur Alkyne
Nama senyawa yang mengandung ikatan C ‚C diakhiri dengan -yne. Sekali lagi, nama senyawa induk ditentukan oleh jumlah atom karbon dalam rantai terpanjang. Seperti dalam kasus alkena, nama-nama alkuna menunjukkan posisi ikatan rangkap tiga karbon-karbon, sebagai contoh, pada
HC=C¬CH2¬CH3 (1-butana) H3C¬C=C¬CH3 (2-butana)
Properti dan Reaksi Alkynes
Alkyne yang paling sederhana adalah ethyne atau lebih dikenal dengan asetilena (C2H2). Asetilena adalah gas tak bewarna (b.p. 284 ° C) yang dibuat oleh reaksi antara kalsium karbida dan air.
CaC2(s) + 2H2O(l) -> C2H2(g) + Ca(OH)2(aq)
24.3 Hidrokarbon Aromatik
Nomenklatur Senyawa Aromatik
Penamaan benzena tersubstitusi, yaitu, benzen di mana satu atom H telah digantikan oleh atom lain atau sekelompok atom.
Jika ada lebih dari satu substituen, kita harus menunjukkan lokasi kelompok kedua relatif terhadap yang pertama. Cara sistematis untuk melakukannya adalah dengan memberi nomor atom karbon.
Sifat dan Reaksi Senyawa Aromatik
Benzene adalah cairan tidak berwarna dan mudah terbakar yang diperoleh terutama dari minyak bumi dan ter batubara. Mungkin sifat kimia benzena yang paling luar biasa adalah kelembaman relatifnya. Meskipun memiliki rumus empiris yang sama dengan asetilen (CH) dan tingkat ketidakjenuhan yang tinggi, senyawa ini jauh kurang reaktif dibandingkan etilen atau asetilena. Stabilitas benzena adalah hasil dari delokalisasi elektron. Sebenarnya, benzena dapat dihidrogenasi, tetapi hanya dengan kesulitan. Reaksi ini dilakukan pada suhu dan tekanan yang jauh lebih tinggi daripada reaksi serupa untuk alkena.
Sejumlah besar senyawa dapat dihasilkan dari zat di mana cincin benzena menyatu. Beberapa dari hidrokarbon aromatik polisiklik ini ditunjukkan pada Gambar 24.7. Senyawa yang paling terkenal adalah naftalena, yang digunakan dalam kapur barus. Senyawa ini dan banyak senyawa serupa lainnya hadir dalam tar batubara. Beberapa senyawa dengan beberapa cincin merupakan karsinogen yang kuat — mereka dapat menyebabkan kanker pada manusia dan hewan lainnya.
Gambar 24.7 Beberapa hidrokarbon aromatik polisiklik. Senyawa yang dilambangkan dengan * adalah karsinogen kuat. Sejumlah besar senyawa semacam itu ada di alam.
24.4 Kimia Gugus Fungsi
Alkohol
Semua alkohol mengandung gugus fungsi hidroksil, ¬OH. Beberapa alkohol umum ditunjukkan pada Gambar 24.8. Etil alkohol, atau etanol, sejauh ini adalah yang paling terkenal. Ini diproduksi secara biologis dengan fermentasi gula atau pati. Dengan tidak adanya oksigen, enzim yang ada dalam kultur bakteri atau ragi mengkatalisasi reaksi.
C6H12O6(aq) enzymes 2CH3CH2OH(aq) + 2CO2(g)
Secara komersial, etanol dibuat dengan reaksi adisi di mana air digabungkan dengan etilen pada suhu sekitar 280 ° C dan 300 atm.
CH2=CH2(g) + H2O(g) -> H2SO4 CH3CH2OH(g)
Etanol memiliki aplikasi yang tak terhitung jumlahnya sebagai pelarut untuk bahan kimia organik dan sebagai senyawa awal untuk pembuatan pewarna, obat sintetis, kosmetik, dan bahan peledak. Ini juga merupakan penyusun minuman beralkohol. Etanol adalah satu-satunya alkohol rantai lurus yang tidak beracun (lebih tepatnya, paling tidak beracun); tubuh kita menghasilkan enzim, yang disebut alkohol dehidrogenase, yang membantu memetabolisme etanol dengan mengoksidasinya menjadi asetaldehida.
Eter
Eter mengandung ikatan R¬O¬R9, di mana R dan R9 adalah gugus hidrokarbon (alifatik atau aromatik). Mereka dibentuk oleh reaksi antara alkoksida (mengandung ion RO2) dan alkil halida.
NaOCH3 + CH3Br -> CH3OCH3 + NaBr
Dietil eter dibuat dalam skala industri dengan memanaskan etanol dengan asam sulfat pada suhu 140 ° C
C2H5OH + C2H5OH -> C2H5OC2H5 + H2O
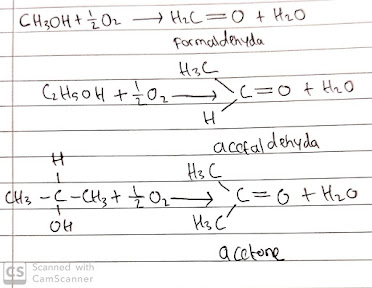
Aldehida dan Keton
Di bawah kondisi oksidasi ringan, dimungkinkan untuk mengubah alkohol menjadi aldehida dan keton.
Gugus fungsional dalam senyawa ini adalah gugus karbonil, C = O. Dalam aldehida setidaknya satu atom hidrogen terikat pada karbon dalam gugus karbonil. Dalam keton, atom karbon dalam gugus karbonil terikat pada dua gugus hidrokarbon. Aldehida, formaldehida (H2C = O) yang paling sederhana memiliki kecenderungan untuk berpolimerisasi; yaitu, molekul individu bergabung bersama untuk membentuk senyawa bermassa molar tinggi. Tindakan ini mengeluarkan banyak panas dan sering meledak, jadi formaldehida biasanya disiapkan dan disimpan dalam larutan air (untuk mengurangi konsentrasi). Cairan berbau tidak sedap ini digunakan sebagai bahan awal dalam industri polimer dan di laboratorium sebagai pengawet spesimen hewan. Menariknya, aldehida bermassa molar lebih tinggi, seperti aldehida sinamat.
Asam karboksilat
Dalam kondisi yang tepat baik alkohol dan aldehida dapat dioksidasi menjadi asam karboksilat, asam yang mengandung gugus karboksil, ¬COOH:
GAMBAR 24.9 Beberapa asam karboksilat umum. Perhatikan bahwa semuanya mengandung gugus COOH. (Glisin adalah salah satu asam amino yang ditemukan dalam protein.)
Reaksi ini terjadi begitu mudah, pada kenyataannya, anggur harus dilindungi dari oksigen atmosfer selama disimpan. Jika tidak, itu akan segera berubah menjadi cuka karena pembentukan asam asetat. Gambar 24.9 menunjukkan struktur beberapa asam karboksilat umum. Asam karboksilat tersebar luas di alam; mereka ditemukan di kerajaan tumbuhan dan hewan. Semua molekul protein terbuat dari asam amino, sejenis asam karboksilat khusus yang mengandung gugus amino (¬NH2) dan gugus karboksil (¬COOH). Berbeda dengan asam anorganik HCl, HNO3, dan H2SO4, asam karboksilat biasanya lemah. Mereka bereaksi dengan alkohol untuk membentuk ester yang berbau sedap.
Ester
Ester memiliki rumus umum R’COOR, di mana R’ dapat berupa H atau gugus hidrokarbon dan R adalah gugus hidrokarbon. Ester digunakan dalam pembuatan parfum dan sebagai agen penyedap dalam industri kembang gula dan minuman ringan. Banyak buah-buahan memiliki bau dan rasa yang khas karena adanya sedikit ester. Sebagai contoh, pisang mengandung 3-metilbutil asetat [CH3COOCH2CH2CH (CH3)2], jeruk mengandung oktil asetat (CH3COOCHCH3C6H13), dan apel mengandung metil butirat (CH3CH2CH2COOCH3).
Kelompok fungsional dalam ester adalah kelompok ¬COOR. Dengan adanya katalis asam, seperti HCl, ester mengalami hidrolisis untuk menghasilkan asam karboksilat dan alkohol. Misalnya, dalam larutan asam, etil asetat terhidrolisis sebagai berikut:
CH3COOC2H5 + H2O <-> CH3COOH + C2H5OH
Amina
Amina adalah basa organik yang memiliki rumus umum R3N, di mana R dapat berupa H atau gugus hidrokarbon. Seperti amonia, reaksi amina dengan air adalah
RNH2 + H2O -> RNH3 + OH
dimana R mewakili gugus hidrokarbon. Seperti semua basa, amina membentuk garam jika dibiarkan bereaksi dengan asam
Ringkasan Kelompok Fungsional
Tabel 24.4 merangkum grup fungsional umum, termasuk grup C = C dan C = C. Senyawa organik biasanya mengandung lebih dari satu gugus fungsi. Secara umum, reaktivitas suatu senyawa ditentukan oleh jumlah dan jenis gugus fungsi dalam susunannya.
D.PERCOBAAN
Berikan nama pada rantai karbon berikut ini:
Langkah pertamanya, Menentukan rantai Terpanjang:
Langkah kedua, beri nomor rantai utama (rantai terpanjang), berdasarkan ujung yang paling dekat dengan cabang/gugus fungsi.
1. Pada soal (a), Penomoran dilakukan dari karbon yang dibawah, karena posisi itu lebih dekat dengan cabang. Cabang terdapat pada karbon nomor 3, dan jenis cabangnya ialah Metil, Maka nama senyawa hidrokarbon ini ialah: 3, Metil heksana
2. Pada soal (b), Penomoran dilakukan dari karbon yang atas, karena posisi itu lebih dekat dengan cabang. Cabang terdapat pada karbon nomor 3, dan jenis cabangnya ialah Etil, Maka nama senyawa hidrokarbon ini ialah: 3, Etil heptana
Untuk Rantai Karbon dengan Dua Atau lebih Cabang
1. Jika terdapat 2 cabang yang sama maka berikan nama (di-) jika 3 (tri-), 4 (tetra-), lima (penta-) dst.
2. Jika terdapat 2 atau lebih cabang berbeda, maka namanya dituliskan berurutan sesuai abjad. Pengurutan ini tidak menyertakan tambahan di-, tri-, tetra-, dst, tetapi memasukkan iso- dan neo-.
VIDEO
A. Prosedur Percobaan






















Tidak ada komentar:
Posting Komentar