1. Tujuan
2. Komponen
1. Sensor Gas MQ-7
Sensor ini biasanya digunakan untuk mendeteksi gas Kabrbon Monoksida (CO)
6. Buzzer DC
Buzzer digunakan sebagai indikator bahwa proses telah selesai atau terjadi suatu kesalahan pada sebuah alat (alarm).
3. Dasar Teori
11.1 Teori Kintetik Cairan dan Padatan;[kembali}
Dalam keadaan gas, jarak antar molekul sangat
besar (dibandingkan dengan diameternya) sehingga pada suhu dan tekanan normal
(biasanya, 25°C dan 1 atm), tidak ada interaksi yang berarti antara molekul.
Karena ada banyak ruang kosong dalam gas — yaitu, ruang yang tidak ditempati
oleh molekul — gas dapat dengan mudah dikompresi atau dimampatkan. Kurangnya
kekuatan gaya antar molekul juga memungkinkan gas untuk mengembang hingga
memenuhi volume wadahnya. Selain itu, ruang kosong yang luas menjelaskan
mengapa gas memiliki kerapatan yang sangat rendah dalam keadaan normal.
Cairan dan padatan adalah keadaan yang sangat
berbeda. Perbedaan utama antara keadaan terkondensasi (cairan dan padatan) dan
keadaan gas adalah jarak antar molekul. Dalam suatu cairan, jarak molekul-molekulnya begitu berdekatan sehingga
hanya ada sedikit ruang kosong yang tersisa. Dengan demikian, cairan jauh lebih sulit untuk dikompres
daripada gas, dan juga jauh lebih padat dalam kondisi normal. Suatu cairan juga
memiliki volume yang pasti, karena molekul-molekul dalam suatu cairan tidak
terlepas dari gaya-gaya atraktif. Namun, molekul dapat bergerak melewati satu
sama lain dengan bebas, sehingga cairan dapat mengalir, dapat dituangkan, dan
menyesuaikan bentuk wadahnya.
Dalam benda padat, molekul dipegang dengan
kaku pada posisi tanpa kebebasan bergerak. Banyak padatan dicirikan oleh
"orde jangka-panjang"; yaitu, molekul diatur dalam konfigurasi
reguler dalam tiga dimensi. Bahkan ada lebih sedikit ruang kosong dalam padatan
daripada dalam cairan. Dengan demikian, padatan hampir tidak dapat dimampatkan
dan memiliki bentuk dan volume yang pasti. Dengan sangat sedikit pengecualian
(air menjadi yang paling penting), kepadatan bentuk padat lebih besar daripada
bentuk cair untuk zat tertentu. Bukan hal yang aneh bagi dua keadaan suatu zat
untuk ada bersama-sama. Contohnya adalah sebuah es batu (padat) yang mengapung dalam
segelas air (cairan). Ahli kimia merujuk
pada berbagai kondisi zat yang ada dalam suatu sistem sebagai fase. Fase merupakan bagian homogen dari sistem dalam kontak
dengan bagian lain dari sistem tetapi dipisahkan darinya oleh batas yang
didefinisikan dengan baik. Jadi, segelas air es mengandung fase padat dan fase
cair air.
Tabel 11.1 merangkum beberapa karakteristik sifat dari tiga
keadaan atau fase materi.

11.2 Gaya antarmolekul;[kembali}
Gaya Antarmolekul adalah gaya tarik-menarik antar molekul. Gaya antarmolekul memberikan pengaruh lebih besar dalam fase materi yang terkondensasi — cairan dan padatan. Saat suhu gas turun, energi kinetik rata-rata dari molekulnya berkurang. Akhirnya, pada suhu yang cukup rendah, molekul tidak lagi memiliki energi yang cukup untuk melepaskan dirinya dari gaya tarik molekul tetangga. Pada titik ini, molekul berkumpul untuk membentuk tetes kecil cairan. Transisi ini dari fase gas ke fase cair dikenal sebuah kondensasi.
Berbeda dari gaya
antarmolekul, gaya intramolekul menahan atom bersama-sama dalam sebuah molekul. Gaya
intramolekul menstabilkan molekul individu, sedangkan gaya antarmolekul terutama bertanggung jawab atas
sifat umum materi (misalnya, titik leleh dan titik didih).
Umumnya, gaya
antarmolekul jauh lebih lemah daripada gaya intramolekul. Biasanya dibutuhkan
energi yang jauh lebih sedikit untuk menguapkan cairan daripada untuk memutus
ikatan dalam molekul cairan. Misalnya, dibutuhkan energi sekitar 41 kJ untuk
menguapkan 1 mol air pada titik didihnya; tetapi dibutuhkan sekitar 930 kJ
energi untuk memutus dua ikatan O-H dalam 1 mol molekul air. Titik didih zat
sering kali mencerminkan kekuatan gaya antarmolekul yang bekerja di antara
molekul. Pada titik didih, energi yang cukup harus disuplai untuk mengatasi
gaya tarik antar molekul sebelum mereka dapat memasuki fase uap. Jika
dibutuhkan lebih banyak energi untuk memisahkan molekul zat A daripada zat B
karena molekul A disatukan oleh gaya antarmolekul yang lebih kuat, maka titik
didih A lebih tinggi daripada titik didih B. Prinsip yang sama berlaku juga
untuk titik leleh zat tersebut. Secara umum, titik leleh zat meningkat dengan
makin kuat gaya antarmolekul.
Untuk membahas
sifat-sifat materi terkondensasi, harus dipahami berbagai jenis gaya
antarmolekul. Gaya dipol-dipol, dipol yang diinduksi dipol, dan gaya dispersi
membentuk apa yang umumnya disebut oleh ahli kimia sebagai gaya van der Waals,
Ion dan dipol tarik menarik satu sama lain oleh gaya elektrostatis yang disebut
gaya ion-dipol, yang bukan merupakan gaya van der Waals. Ikatan hidrogen adalah
jenis interaksi dipol-dipol yang sangat kuat. Karena hanya sedikit unsur yang
dapat berpartisipasi dalam pembentukan ikatan hidrogen, ini diperlakukan
sebagai kategori terpisah. Bergantung pada fase suatu zat, sifat ikatan kimia,
dan jenis unsur yang ada, lebih dari satu jenis interaksi dapat berkontribusi
pada tarikan total antar molekul, seperti yang akan dibahas berikut ini.
Gaya Dipol-Dipol
|
|
|
Gambar 11.1 Molekul yang
memiliki momen dipol permanen cenderung sejajar dengan
polaritas yang berlawanan dalam fasa padat untuk interaksi
tarikan maksimum. |
Gaya dipol-dipol adalah gaya tarik
antarmolekul polar, yaitu antara molekul yang memiliki momen dipol. Asal usulnya adalah elektrostatis, dan dapat
dipahami dalam istilah hukum Coulomb. Semakin besar momen dipol, semakin besar
gaya yang diberikan. Dalam cairan, molekul polar tidak ditahan sekuat padatan,
tetapi cenderung diselaraskan dengan cara dirata-rata untuk memaksimalkan
interaksi tarik menarik.
|
|
|
Gambar 11.2 Dua jenis
interaksi ion-dipol. |
Hidrasi adalah salah satu contoh interaksi ion-dipol. Kalor hidrasi (Bagian 6.7) adalah hasil interaksi yang lebih disukai antara kation dan
anion senyawa ionik dengan air. Interaksi ion-dipol antara ion Na⁺ dan Mg²⁺ dengan molekul air yang memiliki momen dipol
yang besar (1,87 D). Karena ion Mg²⁺ memiliki muatan yang lebih tinggi dan
jari-jari ion yang lebih kecil (78 pm) daripada ion Na⁺ (98 pm), ion ini berinteraksi lebih kuat
dengan molekul air. (Pada kenyataannya, setiap ion dikelilingi oleh sejumlah
molekul air dalam larutan.) Akibatnya, kalor hidrasi untuk ion Na⁺ dan Mg²⁺ masing-masing adalah 2.405 kJ/mol dan 21.926
kJ/mol. Perbedaan serupa terjadi untuk anion dari muatan dan ukuran yang
berbeda.
|
|
|
Gambar 11.3 (a) Interaksi
molekul air dengan ion Na⁺ dan ion Mg²⁺. (b) Dalam larutan air, ion logam
biasanya dikelilingi oleh enam molekul air dalam susunan oktahedral. |
|
|
|
Gambar 11.4 (a) Distribusi
muatan bola dalam atom helium. (b) Distorsi yang disebabkan oleh
pendekatan kation. (c) Distorsi yang disebabkan oleh
pendekatan dipol. |
Jika kita menempatkan ion atau molekul polar di dekat atom (atau
molekul nonpolar), distribusi elektron dari atom (atau molekul) terdistorsi
oleh gaya yang diberikan oleh ion atau molekul polar,
menghasilkan semacam dipol. Dipol dalam atom (atau molekul nonpolar) dikatakan
sebagai dipol terinduksi karena pemisahan muatan positif dan negatif dalam atom
(atau molekul nonpolar) disebabkan oleh kedekatan ion atau molekul polar.
Interaksi tarik menarik antara ion dan dipol yang diinduksi disebut interaksi
dipol yang diinduksi ion, dan interaksi tarik menarik antara molekul polar dan
dipol yang diinduksi disebut interaksi dipol yang diinduksi dipol.
Kemungkinan momen dipol diinduksi tidak hanya bergantung pada
muatan ion atau kekuatan dipol tetapi juga pada polarisasi atom atau molekul
yaitu, kemudahan distribusi elektron dalam atom (atau molekul) dapat
terdistorsi. Umumnya, semakin besar jumlah elektron dan semakin banyak awan
elektron yang tersebar dalam atom atau molekul, semakin besar
polarisabilitasnya. Yang dimaksud dengan awan difusi adalah awan elektron yang
tersebar di volume yang cukup besar, sehingga elektron tidak terikat erat oleh
inti.
Polarisasi memungkinkan gas yang mengandung atom atau molekul
nonpolar (misalnya, He dan N₂)
mengembun. Dalam atom helium, elektron bergerak pada jarak tertentu dari inti.
Setiap saat kemungkinan besar atom memiliki momen dipol yang dibuat oleh posisi
elektron tertentu. Momen dipol ini disebut dipol sesaat karena berlangsung
hanya sepersekian detik. Detik berikutnya elektron berada di lokasi yang
berbeda dan atom memiliki dipol sesaat baru, dan seterusnya. Dirata-ratakan
dari waktu ke waktu (yaitu, waktu yang diperlukan untuk membuat pengukuran
momen dipol), namun, atom tidak memiliki momen dipol karena semua dipol sesaat
saling meniadakan.
Dalam kumpulan atom He, dipol sesaat dari satu atom He dapat
menginduksi dipol di setiap tetangga terdekatnya. Pada saat berikutnya, dipol
sesaat yang berbeda dapat membuat dipol sesaat di sekitar atom He. Poin
pentingnya adalah bahwa jenis interaksi ini menghasilkan gaya dispersi, gaya
tarik yang muncul sebagai akibat dari dipol sementara yang diinduksi dalam atom
atau molekul. Pada suhu yang sangat rendah (dan kecepatan atom berkurang), gaya
dispersi cukup kuat untuk menahan atom He bersama-sama, menyebabkan gas
mengembun. Gaya tarik antar molekul nonpolar dapat dijelaskan dengan cara yang
sama.
|
|
|
Gambar 11.5 Dipol yang
diinduksi berinteraksi satu sama lain. Pola seperti itu hanya ada sesaat;
pengaturan baru dibentuk di saat berikutnya. Jenis interaksi ini bertanggung
jawab atas kondensasi gas nonpolar. |
Interpretasi mekanika kuantum dari dipol sesaat diberikan oleh
Fritz London pada tahun 1930. London menunjukkan bahwa besarnya interaksi tarik
menarik ini berbanding lurus dengan polarisasi atom atau molekul. Seperti yang
diduga, gaya dispersi mungkin cukup lemah. Ini memang benar untuk helium, yang
memiliki titik didih hanya 4,2 K, atau -269 ° C.
. Tabel 11.2 membandingkan
titik leleh zat serupa yang terdiri dari molekul nonpolar
Gaya dispersi, yang juga disebut gaya London,
biasanya meningkat seiring dengan massa molar karena molekul dengan massa molar
yang lebih besar cenderung memiliki lebih banyak elektron, dan gaya dispersi
bertambah kuat seiring dengan bertambahnya jumlah elektron. Lebih jauh lagi,
massa molar yang lebih besar seringkali berarti atom yang lebih besar yang
distribusi elektronnya lebih mudah terganggu karena elektron terluarnya kurang
terikat erat oleh inti. Seperti yang diharapkan, titik leleh meningkat seiring
dengan meningkatnya jumlah elektron dalam molekul. Karena ini semua adalah
molekul nonpolar, satu-satunya gaya antarmolekul tarik menarik adalah gaya
dispersi.
Dalam banyak kasus, gaya dispersi sebanding dengan atau bahkan
lebih besar dari gaya dipol-dipol antara molekul polar. Sebagai ilustrasi,
bandingkan titik didih CH₃F (278,4°C) dan CCl₄ (76,5°C). Meskipun CH₃F memiliki momen dipol 1,8 D, tetapi memiliki
titik didih pada suhu yang jauh lebih rendah daripada CCl₄ yang merupakan molekul nonpolar. CCl₄ mendidih pada suhu yang lebih tinggi karena
mengandung lebih banyak elektron. Akibatnya, gaya dispersi antar molekul CCl₄ lebih kuat daripada gaya dispersi ditambah
gaya dipol-dipol antara molekul CH₃F. (Ingatlah bahwa gaya dispersi terjadi di
antara spesi dari semua jenis, baik netral maupun bermuatan bersih dan apakah
polar atau nonpolar.)
Ikatan Hidrogen
Biasanya, titik didih
rangkaian senyawa serupa yang mengandung unsur-unsur dalam kelompok periodik
yang sama meningkat seiring dengan bertambahnya massa molar. Peningkatan titik
didih ini disebabkan oleh peningkatan gaya dispersi untuk molekul dengan lebih
banyak elektron. Senyawa teringan, CH₄, memiliki titik didih terendah, dan senyawa
terberat SnH₄ memiliki titik didih
tertinggi. Namun, senyawa hidrogen dari unsur-unsur di Grup 5A, 6A, dan 7A
tidak mengikuti tren ini. Dalam masing-masing deret ini, senyawa paling ringan
(NH₃, H₂O, dan HF) memiliki titik didih tertinggi,
bertentangan dengan perkiraan berdasarkan massa molar. Pengamatan ini harus
berarti bahwa ada gaya tarik antarmolekul yang lebih kuat pada NH₃, H₂O, dan HF, dibandingkan dengan molekul lain
dalam golongan yang sama. Faktanya, jenis tarikan antarmolekul yang sangat kuat
ini disebut ikatan hidrogen, yang merupakan jenis interaksi dipol-dipol khusus
antara atom hidrogen dalam ikatan polar, seperti N-H, O-H, atau F-H, dan
elektronegatif ataom O, N, atau F. Interaksi itu ditulis sebagai :
A-H --- B
atau A-H --- A
A dan B mewakili O, N, atau F; A-H adalah satu molekul atau
bagian dari sebuah molekul dan B adalah bagian dari molekul lain; dan garis
putus-putus melambangkan ikatan hidrogen. Ketiga atom tersebut biasanya
terletak pada garis lurus, tetapi sudut AHB (atau AHA) dapat menyimpang sebesar
30° dari linieritas. Perhatikan bahwa atom O, N, dan F semuanya memiliki
setidaknya satu pasangan elektron bebas yang dapat berinteraksi dengan atom
hidrogen dalam ikatan hidrogen.
|
|
|
Gambar 11.6 Titik didih
senyawa hidrogen dari unsur Golongan 4A, 5A, 6A, dan 7A. Meskipun biasanya
kita mengharapkan titik didih meningkat saat kita bergerak ke bawah suatu
golongan, kita melihat bahwa tiga senyawa (NH₃, H₂O, dan HF) berperilaku
berbeda. |
Kekuatan rata-rata ikatan hidrogen cukup besar untuk interaksi
dipol-dipol (hingga 40 kJ/mol). Dengan demikian, ikatan hidrogen memiliki
pengaruh yang kuat pada struktur dan sifat banyak senyawa. Gambar 11.7
menunjukkan beberapa contoh ikatan hidrogen.
|
|
|
Gambar 11.7 Ikatan hidrogen
dalam air, amonia, dan hidrogen fluorida. Garis padat mewakili ikatan
kovalen, dan garis putus-putus mewakili ikatan hidrogen. |
Kekuatan ikatan
hidrogen ditentukan oleh interaksi coulomb antara pasangan elektron bebas dari
atom elektronegatif dan inti hidrogen. Misalnya, fluor lebih elektronegatif
daripada oksigen, jadi kita mengharapkan ikatan hidrogen yang lebih kuat ada di
HF cair daripada di H₂O. Dalam fase cair,
molekul HF membentuk rantai zigzag:
Titik didih HF lebih rendah daripada titik didih air karena
setiap H₂O mengambil bagian
dalam empat ikatan hidrogen antarmolekul. Oleh karena itu, gaya yang menahan
molekul lebih kuat di H₂O daripada di HF.
Gaya antarmolekul memunculkan sejumlah fitur
struktural dan sifat cairan. Pada bagian ini kita akan melihat dua fenomena
yang berhubungan dengan cairan secara umum: tegangan permukaan dan viskositas.
Kemudian kita akan membahas struktur dan sifat air.
|
|
|
Gambar
11.8 Gaya antarmolekul yang bekerja pada
sebuah molekul di lapisan permukaan cairan dan
di wilayah interior cairan. |
Tegangan Permukaan
Molekul di dalam cairan ditarik ke segala arah oleh gaya
antarmolekul; tidak ada kecenderungan bagi molekul-molekul untuk ditarik dengan
satu cara. Namun, molekul di permukaan ditarik ke bawah dan ke samping oleh
molekul lain, tetapi tidak menjauh dari permukaan. Gaya tarik antarmolekul ini
dengan demikian cenderung menarik molekul ke dalam cairan dan menyebabkan
permukaan menegang seperti film elastis. Karena ada sedikit atau tidak ada
tarikan antara molekul air polar dan, katakanlah, molekul lilin nonpolar pada
mobil baru yang dilapisi lilin, setetes air mengambil bentuk manik bundar
kecil, karena bentuk bola meminimalkan luas permukaan cairan. Permukaan lilin
dari apel basah juga menghasilkan efek ini.
|
|
|
Gambar
11.9 Manik-manik air pada apel, yang
memiliki permukaan lilin. |
Ukuran gaya elastis di permukaan zat cair
disebut tegangan permukaan. Tegangan permukaan adalah jumlah energi yang
dibutuhkan untuk meregangkan atau meningkatkan permukaan zat cair sebesar
satuan luas (misalnya sebesar 1 cm²). Cairan yang memiliki gaya antarmolekul
yang kuat juga memiliki tegangan permukaan yang tinggi. Jadi, karena ikatan
hidrogen, air memiliki tegangan permukaan yang jauh lebih besar daripada
kebanyakan cairan lainnya.
Contoh lain dari tegangan permukaan adalah aksi kapiler.
Segumpal air tipis menempel di dinding tabung kaca. Tegangan permukaan air
menyebabkan film ini berkontraksi, dan seperti yang terjadi, ia menarik air ke
atas tabung. Dua jenis gaya menghasilkan aksi kapiler. Salah satunya adalah
kohesi, yang merupakan daya tarik antarmolekul antara molekul sejenis (dalam
hal ini, molekul air). Gaya kedua, yang disebut adhesi, adalah gaya tarik
antara molekul yang berbeda, seperti yang ada di air dan di sisi tabung kaca.
Jika daya rekat lebih kuat dari kohesi, seperti pada isi tabung akan ditarik ke atas. Proses ini
berlanjut hingga gaya perekat seimbang dengan berat air di dalam tabung. Aksi
ini sama sekali tidak universal di antara zat cair, seperti yang ditunjukkan.
Dalam merkuri, kohesi lebih besar daripada adhesi antara merkuri dan kaca,
sehingga ketika tabung kapiler dicelupkan ke dalam merkuri, hasilnya berkurang
atau terjadi penurunan pada merkuri yaitu, ketinggian cairan dalam tabung kapiler
berada di bawah permukaan merkuri.
|
|
|
Gambar 11.10 a)
Ketika adhesi lebih besar dari kohesi, cairan (misalnya, air) naik ke dalam
tabung kapiler. (b) Ketika kohesi lebih besar dari adhesi, seperti pada
merkuri, penurunan cairan dalam tabung kapiler terjadi. Perhatikan bahwa
meniskus di dalam tabung air itu cekung, atau membulat ke bawah, sedangkan di
dalam tabung air raksa berbentuk cembung, atau dibulatkan ke atas. |
Viskositas
Viskositas adalah ukuran ketahanan fluida terhadap
aliran. Semakin besar viskositasnya, semakin lambat cairan mengalir. Viskositas
cairan biasanya menurun dengan meningkatnya suhu; dengan demikian, cairan panas
mengalir lebih cepat daripada cairan dingin.
Cairan yang memiliki gaya antarmolekul kuat memiliki viskositas lebih
tinggi daripada yang memiliki gaya antarmolekul lemah. Air memiliki viskositas
yang lebih tinggi daripada banyak cairan lain karena kemampuannya membentuk
ikatan hidrogen. Menariknya, viskositas gliserol secara signifikan lebih tinggi
daripada semua cairan lain yang tercantum dalam Tabel 11.3. Gliserol memiliki
struktur
:
Seperti air, gliserol dapat membentuk ikatan hidrogen. Setiap
molekul gliserol memiliki tiga gugus -OH yang dapat berpartisipasi dalam ikatan
hidrogen dengan molekul gliserol lainnya.
Lebih jauh lagi, karena bentuknya,
molekul-molekul memiliki kecenderungan besar untuk terjerat daripada melewati
satu sama lain seperti yang dilakukan molekul-molekul cairan yang kurang
kental. Interaksi ini berkontribusi pada viskositasnya yang tinggi.
Struktur dan Sifat Air
Air adalah zat yang sangat umum di Bumi sehingga kita sering
mengabaikan sifat uniknya. Semua proses kehidupan melibatkan air. Air adalah
pelarut yang sangat baik untuk banyak senyawa ionik, serta zat lain yang mampu membentuk
ikatan hidrogen dengan air.
Seperti yang ditunjukkan Tabel 6.2, air memiliki kalor spesifik
yang tinggi. Alasannya adalah untuk menaikkan suhu air (yaitu, untuk
meningkatkan energi kinetik rata-rata molekul air), pertama-tama harus
diputuskan banyak ikatan hidrogen antarmolekul. Dengan demikian, air dapat
menyerap sejumlah besar kalor sementara suhunya hanya naik sedikit.
Kebalikannya juga benar: Air dapat mengeluarkan banyak kalor hanya dengan
sedikit penurunan suhunya. Untuk alasan ini, sejumlah besar air yang ada di
danau dan lautan dapat secara efektif memoderasi iklim di area daratan yang
berdekatan dengan menyerap kalor di musim panas dan melepaskan kalor di musim
dingin, dengan hanya sedikit perubahan suhu air.
Sifat air yang paling mencolok adalah bahwa bentuk padatnya
kurang rapat daripada bentuk cairnya: es mengapung di permukaan air cair. Massa
jenis hampir semua zat lain lebih besar dalam bentuk padat daripada dalam
bentuk cair.
|
|
|
Gambar
11.11 Kiri: Es batu mengapung di atas air. Kanan: Bensol padat tenggelam
ke dasar benzena cair. |
Untuk memahami mengapa air berbeda, harus
diperiksa struktur elektron dari molekul H₂O. Seperti yang dibahas di Bab 9, ada dua
pasang elektron non-ikatan, atau dua pasangan elektron bebas, pada atom
oksigen:
Meskipun banyak senyawa dapat membentuk ikatan
hidrogen antarmolekul, perbedaan antara H₂O dan molekul polar lainnya, seperti NH₃ dan HF, adalah bahwa setiap atom oksigen
dapat membentuk dua ikatan hidrogen, sama dengan jumlah pasangan elektron bebas
pada atom oksigen. Dengan demikian, molekul air bergabung bersama dalam
jaringan tiga dimensi yang luas di mana setiap atom oksigen terikat secara
tetrahedral pada empat atom hidrogen, dua oleh ikatan kovalen dan dua oleh ikatan
hidrogen. Persamaan jumlah atom hidrogen dan pasangan elektron bebas ini
bukanlah karakteristik NH₃ atau HF atau, dalam
hal ini, molekul lain yang mampu membentuk ikatan hidrogen. Akibatnya,
molekul-molekul lain ini dapat membentuk cincin atau rantai, tetapi tidak
dengan struktur tiga dimensi.
|
|
|
Gambar 11.12 Struktur tiga
dimensi es. Setiap atom O terikat pada empat atom H. Ikatan kovalen
ditunjukkan oleh garis padat pendek dan ikatan hidrogen yang lebih lemah
dengan garis putus-putus panjang antara O dan H. Ruang kosong pada struktur
menjelaskan kerapatan es yang rendah. |
|
|
|
Gambar 11.13 Plot kerapatan
terhadap suhu untuk air cair. Kerapatan maksimum air dicapai
pada 4 °C. Massa jenis es pada 0 °C adalah
sekitar 0,92 g/cm³. |
Struktur tiga dimensi es yang sangat teratur mencegah molekul-molekul agar tidak terlalu
dekat satu sama lain. Tetapi pertimbangkan apa yang terjadi ketika es mencair.
Pada titik leleh, sejumlah molekul air memiliki energi kinetik yang cukup untuk
melepaskan ikatan hidrogen antarmolekul. Molekul-molekul ini terperangkap di
rongga struktur tiga dimensi, yang dipecah menjadi kelompok-kelompok yang lebih
kecil. Akibatnya, ada lebih banyak molekul per satuan volume di air cair
daripada di es. Jadi, karena massa jenis = massa/volume, massa jenis air lebih
besar daripada massa jenis es. Dengan pemanasan lebih lanjut, lebih banyak
molekul air yang dilepaskan dari ikatan hidrogen antarmolekul, sehingga massa
jenis air cenderung meningkat dengan kenaikan suhu tepat di atas titik leleh.
Tentunya pada saat yang sama air mengembang saat dipanaskan sehingga massa
jenisnya menurun. Kedua proses ini terperangkapnya molekul air bebas dalam rongga dan pemuaian
termal bertindak dalam arah yang berlawanan. Dari 0
°C hingga 4 °C, perangkap berlaku dan air menjadi semakin padat. Namun, di luar
4 °C, ekspansi termal mendominasi dan kerapatan air menurun dengan meningkatnya
suhu.
11.4 Struktur Kristal;[kembali}
Padatan dapat dibagi menjadi dua kategori: kristal dan amorf. Es
adalah padatan kristal, yang kaku dan memiliki tatanan jarak-jauh; atom,
molekul, atau ionnya menempati posisi tertentu. Susunan partikel-partikel
seperti itu dalam padatan kristal sedemikian rupa sehingga gaya tarik menarik
bersih antarmolekul mencapai maksimum. Gaya yang bertanggung jawab atas
stabilitas kristal dapat berupa gaya ionik, ikatan kovalen, gaya van der Waals,
ikatan hidrogen, atau kombinasi dari gaya-gaya ini. Padatan amorf seperti kaca
tidak memiliki susunan yang jelas dan tatanan molekul jarak-jauh. Akan dibahas
di Bagian 11.7. Pada bagian ini, akan dikonsentrasikan pada struktur padatan
kristal.
|
|
|
Gambar 11.14 a)
Sel satuan dan (b) perluasannya dalam tiga dimensi. Bola hitam mewakili atom
atau molekul. |
Sel satuan adalah satuan dasar struktural berulang
dari padatan kristal. Gambar 11.14 menunjukkan sel satuan dan ekstensinya dalam
tiga dimensi. Setiap bola mewakili atom, ion, atau molekul dan disebut titik
kisi. Dalam banyak kristal, titik kisi sebenarnya tidak mengandung partikel
seperti itu. Sebaliknya, mungkin ada beberapa atom, ion, atau molekul yang
disusun secara identik di sekitar setiap titik kisi. Untuk kesederhanaan,
bagaimanapun, kita dapat mengasumsikan bahwa setiap titik kisi ditempati oleh
sebuah atom. Hal ini tentunya terjadi pada kebanyakan logam. Setiap padatan
kristal dapat dijelaskan dalam salah satu dari tujuh jenis sel satuan yang
ditunjukkan pada Gambar 11.15. Geometri sel satuan kubik sangat sederhana
karena semua sisi dan semua sudut adalah sama. Salah satu sel satuan, bila diulang
di ruang tiga dimensi, membentuk karakteristik struktur kisi dari padatan
kristal.
|
|
|
Gambar
11.15 Tujuh jenis sel satuan. Sudut 𝛼 ditentukan oleh tepi b dan c, sudut 𝛽 dengan tepi a dan c, dan sudut 𝛾 dengan tepi a dan b. |
Pengemasan Bola
Kita dapat memahami persyaratan geometris umum untuk pembentukan
kristal dengan mempertimbangkan berbagai cara mengemas sejumlah bola identik
(bola Ping-Pong, misalnya) untuk membentuk struktur tiga dimensi yang teratur.
Cara bola disusun dalam lapisan menentukan jenis sel satuan yang
dimiliki.
|
|
|
Gambar 11.16 Susunan bola
identik dalam sel kubus sederhana. (a) Tampilan atas dari satu lapisan bola.
(b) Gambar sel kubus sederhana. (c) Karena setiap bola dibagi oleh delapan
sel satuan dan ada delapan sudut dalam kubus, ada ekivalen dengan satu bola
utuh di dalam sel satuan kubus sederhana. |
Struktur tiga dimensi dapat dibuat dengan
menempatkan lapisan di atas dan di bawah lapisan ini sedemikian rupa sehingga
bola dalam satu lapisan berada tepat di atas bola di lapisan di bawahnya.
Prosedur ini dapat diperpanjang untuk menghasilkan lebih banyak lapisan,
seperti dalam kasus kristal. Berfokus pada bola berlabel "x," kita
melihat bahwa itu bersentuhan dengan empat bola di lapisannya sendiri, satu
bola di lapisan atas, dan satu bola di lapisan bawah. Setiap bola dalam susunan
ini dikatakan memiliki bilangan koordinasi 6 karena memiliki enam tetangga
langsung. Bilangan koordinasi didefinisikan sebagai jumlah atom (atau ion) yang
mengelilingi atom (atau ion) dalam kisi kristal. Nilainya memberikan ukuran
seberapa erat bola-bola itu dikemas bersama — semakin besar bilangan
koordinasinya, semakin dekat bola satu sama lain. Satuan dasar dan berulang
dalam larik bola disebut sel kubus sederhana (scc).
|
|
|
Gambar 11.17 Tiga jenis sel
kubus. Pada kenyataannya, bola yang mewakili atom, molekul, atau ion
bersentuhan satu sama lain dalam sel kubus ini. |
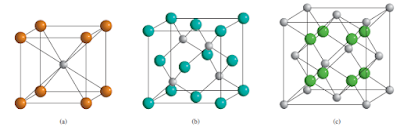
Jenis sel kubus lainnya adalah sel kubus berpusat badan (bcc)
dan sel kubik berpusat muka (fcc). Susunan kubus berpusat badan berbeda dari
kubus sederhana di mana lapisan kedua bola masuk ke dalam cekungan lapisan
pertama dan lapisan ketiga ke dalam cekungan lapisan kedua. Bilangan koordinasi
setiap bola dalam struktur ini adalah 8 (setiap bola bersentuhan dengan empat
bola di lapisan atas dan empat bola di lapisan bawah). Dalam sel kubus berpusat
muka, ada bola di tengah masing-masing dari enam sisi kubus, selain delapan
bola sudut.
|
|
|
Gambar 11.18 Susunan bola
identik dalam kubus berpusat badan. (a) Tampak atas. (b) Gambar sel satuan
kubus berpusat badan. (c) Ada ekuivalen dengan dua bola lengkap di dalam sel
satuan kubus berpusat badan. |
Karena setiap sel satuan dalam padatan kristal
berdekatan dengan sel satuan lainnya, sebagian besar sel atom-atom digunakan bersama
oleh sel tetangga. Misalnya, dalam semua jenis sel kubus, setiap atom sudut
termasuk dalam delapan sel satuan [Gambar 11.19 (a)]; atom tepi dibagi oleh empat
sel satuan, dan atom berpusat muka dibagi oleh dua sel satuan. Karena setiap
bola sudut dibagi oleh delapan sel satuan dan ada delapan sudut dalam kubus,
maka hanya akan ada satu bola yang lengkap di dalam sel satuan kubik sederhana.
Sebuah sel kubus berpusat badan berisi setara dengan dua bola lengkap, satu di
tengah dan delapan bola sudut bersama. Sebuah sel kubus berpusat muka berisi
empat bola lengkap — tiga dari enam atom berpusat muka dan satu dari delapan
bola sudut bersama.
|
|
|
Gambar
11.19 (a) Sebuah atom sudut di setiap sel dibagi dengan delapan sel
satuan. (b) Sebuah atom tepi dibagi oleh empat sel satuan. (c) Sebuah atom
yang berpusat muka dalam sel kubus dibagi oleh dua sel satuan. |
Pengemasan Terdekat
Jelas ada lebih banyak ruang kosong di kubus sederhana dan sel
kubus berpusat badan daripada di sel kubus berpusat nuka. Pengemasan terdekat,
susunan bola yang paling efisien, dimulai dengan struktur yang ditunjukkan pada
Gambar 11.20 (a), yang disebut lapisan A. Berfokus pada satu-satunya bidang
tertutup, dilihat bahwa ia memiliki enam tetangga langsung di lapisan itu. Pada
lapisan kedua (yang disebut lapisan B), bola dikemas ke dalam cekungan antara
bola di lapisan pertama sehingga semua bola sedekat mungkin.
|
|
|
Gambar 11.20 (a) Dalam
lapisan tertutup, setiap bola bersentuhan dengan enam bola lainnya. (b) Bola
di lapisan kedua masuk ke dalam cekungan di antara bola lapisan pertama. (c)
Dalam struktur rapat-rapat heksagonal, setiap bola lapisan ketiga berada
tepat di atas bola lapisan pertama. (d) Dalam struktur kubus padat, setiap
bola lapisan ketiga masuk ke dalam cekungan yang secara langsung di atas
cekungan di lapisan pertama. |
Ada dua cara agar bola lapisan ketiga menutupi
lapisan kedua untuk mencapai pengemasan terdekat. Bola mungkin dicocokan ke
dalam cekungan sehingga setiap bola lapis ketiga langsung di atas bola lapis pertama.
Karena tidak ada perbedaan antara susunan lapisan pertama dan ketiga, dapat
disebut juga lapisan lapisan ketiga A. Alternatifnya, lapisan lapisan ketiga
mungkin masuk ke dalam cekungan yang terletak langsung di atas cekungan di lapisan
pertama. Dalam hal ini, disebut lapisan lapisan ketiga C. Susunan ABA dikenal
sebagai struktur heksagonal pengemasan tedekat (hcp), dan susunan ABC adalah
struktur kubus padat (ccp), yang sesuai dengan kubus berpusat muka yang telah
dijelaskan. Perhatikan bahwa dalam struktur hcp, bola di setiap lapisan lainnya
menempati posisi vertikal yang sama (ABABAB...), Sedangkan dalam struktur ccp,
bola di setiap lapisan keempat menempati posisi vertikal yang sama
(ABCABCA...). Pada kedua struktur, setiap bola memiliki bilangan koordinasi 12
(setiap bola bersentuhan dengan enam bola di lapisannya sendiri, tiga bola di
lapisan atas, dan tiga bola di lapisan bawah). Baik struktur hcp maupun ccp
menunjukkan cara yang paling efisien untuk mengemas bola identik dalam sel
satuan, dan tidak ada cara untuk meningkatkan bilangan koordinasi melebihi 12.
|
|
|
Gambar 11.21 Tampak meledak
dari (a) struktur padat heksagonal dan (b) struktur pengemasan tertutup
kubus. Panah dimiringkan untuk memperlihatkan sel satuan kubus yang berpusat
muka dengan lebih jelas. Perhatikan bahwa pengaturan ini sama dengan sel
satuan berpusat muka. |
Banyak logam dan gas mulia, yang bersifat
monoatomik, membentuk kristal dengan struktur hcp atau ccp. Misalnya,
magnesium, titanium, dan seng mengkristal dengan atomnya dalam susunan hcp,
sedangkan aluminium, nikel, dan perak mengkristal dalam susunan ccp. Semua gas
mulia padat memiliki struktur ccp kecuali helium, yang mengkristal dalam
struktur hcp. Wajar untuk bertanya mengapa serangkaian zat terkait, seperti
logam transisi atau gas mulia, akan membentuk struktur kristal yang berbeda.
Jawabannya terletak pada kestabilan relatif dari struktur kristal tertentu,
yang diatur oleh gaya antarmolekul. Jadi, logam magnesium memiliki struktur hcp
karena susunan atom Mg ini menghasilkan stabilitas padatan yang paling besar.
|
|
|
Gambar
11.22 Hubungan antara panjang tepi (a) dan jari-jari (r) atom dalam sel
kubus sederhana, sel kubus berpusat badan, dan sel kubus berpusat muka. |
Gambar 11.22 meringkas hubungan antara jari-jari atom r dan
panjang tepi a sel kubus sederhana, sel kubus berpusat badan, dan sel kubus
berpusat muka. Hubungan ini dapat digunakan untuk menentukan jari-jari atom
bola jika kerapatan kristal diketahui, seperti yang ditunjukkan pada Contoh
11.3.
Contoh 11.3
Emas (Au) mengkristal dalam struktur kubus padat (sel satuan
kubus berpusat muka) dan memiliki massa jenis 19,3 g/cm³. Hitung jari-jari atom
emas dalam pikometer.
Penyelesaian
Langkah 1: diketahui massa jenis, jadi untuk menentukan volume,
menggunakan massa sel satuan. Setiap sel satuan memiliki delapan sudut dan enam
muka. Jumlah atom dalam sel seperti itu, menurut Gambar 11.19, adalah
(8 x 1/8) + (6 x1/2) = 4
Massa sel satuan dalam gram adalah
Dari definisi massa jenis (d = m / V), dapat dihitung volume sel
satuan sebagai berikut:
Langkah 2: Karena volume adalah panjang pangkat tiga (kubik),
maka diambil akar pangkat tiga dari volume sel satuan untuk mendapatkan panjang
tepi (a) sel satuan
Langkah 3: Dari Gambar 11.22 dapat dilihat bahwa jari-jari (r)
bola Au berhubungan dengan panjang tepi oleh
a = √8r
sehingga
11.5 Difraksi Sinar-X oleh Kristal;[kembali}
Hampir semua yang kita ketahui tentang
struktur kristal telah dipelajari dari studi difraksi sinar-X. Difraksi sinar-X
mengacu pada hamburan sinar-X oleh satuan-satuan zat padat kristalin. Pola
hamburan, atau difraksi, yang dihasilkan digunakan untuk menyimpulkan susunan
partikel dalam kisi padat.
Karena sinar X adalah salah satu bentuk
radiasi elektromagnetik, dan oleh karena itu gelombang, diharapkannya
menunjukkan perilaku seperti itu dalam kondisi yang sesuai. Pada tahun 1912,
fisikawan Jerman Max von Laue dengan tepat menyarankan bahwa, karena panjang
gelombang sinar X sebanding dengan besarnya jarak antara titik kisi dalam
sebuah kristal, kisi tersebut harus dapat mendifraksi sinar X. Pola difraksi
sinar-X merupakan hasil interferensi gelombang yang terkait dengan sinar-X.
|
|
|
Gambar 11.23 Pengaturan untuk
mendapatkan pola difraksi sinar-X dari sebuah kristal. Perisai mencegah
sinar-X kuat yang tidak terdifraksi merusak pelat fotografi. |
Gambar 11.23 menunjukkan konfigurasi difraksi
sinar-X yang khas. Seberkas sinar X diarahkan ke kristal yang terpasang.
Atom-atom dalam kristal menyerap sebagian radiasi yang masuk dan kemudian
memancarkannya kembali; proses ini disebut hamburan sinar-X.
|
|
|
Gambar 11.24 Refleksi sinar X
dari dua lapisan atom. Gelombang bawah menempuh jarak 2d sin 𝛳 lebih panjang dari gelombang atas. Agar kedua gelombang
berada dalam satu fasa lagi setelah refleksi, harus benar bahwa 2d sin 𝛳 = n𝜆, di mana 𝜆 adalah
panjang gelombang sinar-X dan n = 1, 2, 3.. . . Titik tajam pada Gambar 11.23
diamati hanya jika kristal cukup besar untuk terdiri dari ratusan lapisan
paralel. |
Untuk memahami bagaimana pola difraksi dapat
dihasilkan, pertimbangkan hamburan sinar-X oleh atom dalam dua bidang paralel
(Gambar 11.24). Awalnya, dua sinar datang berada dalam fase satu sama lain
(maksimum dan minimumnya terjadi pada posisi yang sama). Gelombang atas
dihamburkan, atau dipantulkan, oleh atom di lapisan pertama, sedangkan
gelombang bawah dihamburkan oleh atom di lapisan kedua. Agar kedua gelombang
yang tersebar ini menjadi satu fase lagi, jarak ekstra yang ditempuh oleh
gelombang yang lebih rendah harus merupakan kelipatan integral dari panjang
gelombang (l) sinar X; hal itu merupakan,
BC + CD = 2d sin 𝜃 = n𝜆 n = 1, 2, 3, . . .
atau
Contoh 11.4
Sinar X dengan panjang gelombang 0,154 nm menabrak kristal
aluminium; sinar tersebut dipantulkan pada sudut 19,3°. Dengan asumsi bahwa n =
1, hitung jarak antara bidang atom aluminium (dalam pm) yang bertanggung jawab
atas sudut refleksi ini. Faktor konversi diperoleh dari 1 nm = 1000 pm.
Mengubah panjang gelombang menjadi pikometer dan menggunakan
sudut refleksi (19,3°), dapat diulis
Teknik difraksi sinar-X menawarkan metode
paling akurat untuk menentukan panjang ikatan dan sudut ikatan dalam molekul
dalam keadaan padat. Karena sinar X dihamburkan oleh elektron, kimiawan dapat
membuat peta kontur kerapatan elektron dari pola difraksi dengan menggunakan
prosedur matematika yang kompleks. Pada dasarnya, peta kontur kerapatan
elektron memberikan data kerapatan elektron relatif di berbagai lokasi dalam
sebuah molekul. Massa jenis mencapai maksimum di dekat pusat setiap atom.
Dengan cara ini, kita dapat menentukan posisi inti dan parameter geometri
molekulnya.
Struktur dan sifat kristal, seperti titik
leleh, kerapatan, dan kekerasan, ditentukan oleh jenis-jenis kekuatan yang
menyatukan partikel. Kristal dapat diklasifikasikan ke dalam salah satu dari
empat jenis ini, yaitu: kristal ionik, kristal kovalen, kristal molekul, atau
kristal logam.
|
|
|
Gambar 11.25 Hubungan antara
jari-jari ion Na⁺ dan Cl⁻ dan dimensi sel satuan. Di sini panjang
tepi sel sama dengan dua kali jumlah dua jari-jari ionik. |
Kristal Ionik
Kristal ionik memiliki dua karakteristik
penting:
(1) Tersusun dari spesi bermuatan
(2) anion dan kation yang umumnya berukuran sangat berbeda.
Mengetahui jari-jari ion sangat membantu dalam
memahami struktur dan stabilitas senyawa ini. Tidak ada cara untuk mengukur
jari-jari suatu ion, tetapi kadang-kadang dimungkinkan untuk menghasilkan
perkiraan yang masuk akal. Sebagai contoh, jika diketahui jari-jari I₂ di KI sekitar 216 pm, maka dapat ditentukan
jari-jari ion K⁺ di KI, dan dari situ,
jari-jari Cl⁻ di KCl, dan
seterusnya. Jari-jari ion pada Gambar 8.9 adalah nilai rata-rata yang
diturunkan dari banyak senyawa berbeda. Mari kita perhatikan kristal NaCl, yang
memiliki kisi kubus berpusat muka (lihat Gambar 2.13). Gambar 11.25 menunjukkan
bahwa panjang tepi sel satuan NaCl adalah dua kali jumlah jari-jari ion Na⁺ dan Cl⁻. Dengan menggunakan nilai yang diberikan pada
Gambar 8.9, dapat dihitung panjang tepi adalah 2 (95 + 181) pm, atau 552 pm.
|
|
|
Gambar 11.26 Struktur kristal (a) CsCl, (b) ZnS, dan (c)
CaF₂. Dalam setiap gambar, kation adalah bola yang lebih kecil. |
Karena Cs⁺ jauh lebih besar dari Na⁺, CsCl memiliki kisi kubus sederhana. ZnS
memiliki struktur campuran seng, yang didasarkan pada kisi kubus berpusat muka.
Jika ion S²⁻ menempati titik kisi,
ion Zn²⁺ terletak seperempat
dari jarak diagonal setiap badan. Senyawa ionik lain yang memiliki struktur
campuran seng antara lain CuCl, BeS, CdS, dan HgS. CaF₂ memiliki struktur fluorit. Ion Ca²⁺ menempati titik kisi, dan setiap ion F⁻ dikelilingi secara tetrahedral oleh empat ion
Ca²⁺. Senyawa SrF₂, BaF₂, BaCl₂, dan PbF₂ juga berstruktur fluorit.
Contoh 11.5
Berapa ion Na⁺
dan Cl⁻ di setiap sel satuan
NaCl?
Penyelesaian
NaCl memiliki struktur berdasarkan kisi kubus berpusat muka.
Seperti yang ditunjukkan Gambar 2.13, satu ion Na⁺ utuh berada di tengah sel satuan, dan ada dua
belas ion Na⁺ di tepinya. Karena
setiap ion Na⁺ tepi dibagi oleh
empat sel satuan [lihat Gambar 11.19 (b)], jumlah total ion Na⁺ adalah 1 + (12 x 1/4) = 4. Demikian pula, ada
enam ion Cl⁻ di pusat muka dan
delapan Ion Cl⁻ di sudut. Setiap ion
berpusat muka dibagi oleh dua sel satuan, dan setiap ion sudut dibagi oleh
delapan sel satuan [lihat Gambar 11.19 (a) dan (c)], sehingga jumlah total ion
Cl⁻ adalah (6 x 1/2) + (8
x 1/8) = 4. Jadi, ada empat ion Na⁺ dan empat ion Cl⁻ di setiap sel satuan NaCl. Gambar 11.27
menunjukkan bagian ion Na⁺ dan Cl⁻ di dalam sel satuan.
|
|
|
Gambar 11.27 Porsi ion Na⁺
dan Cl⁻ dalam sel satuan kubus berpusat muka. |
Contoh 11.6
Panjang tepi sel satuan NaCl adalah 564 pm. Berapa massa jenis
NaCl dalam g/cm³?
Penyelesaian
Dari Contoh 11.5 diketahui bahwa ada empat ion Na⁺ dan empat ion Cl⁻ di setiap sel satuan. Jadi massa total (dalam
sma) dari sel satuan adalah
massa = 4 (22,99 sma + 35,45 sma) = 233,8 sma
Mengubah sma menjadi gram, dapat ditulis
Volume sel satuan adalah V = a³ = (564 pm)³. Mengubah pm³ ke
cm³, volumenya dihitung dengan
Terakhir, dari definisi massa jenis
Sebagian besar kristal ionik memiliki titik leleh yang tinggi,
yang menunjukkan kekuatan kohesif yang kuat yang menahan ion bersama. Ukuran
stabilitas kristal ionik adalah energi kisi, semakin tinggi energi kisi, semakin stabil
senyawa tersebut. Padatan ini tidak menghantarkan listrik karena ion-ionnya
tetap pada posisinya. Akan tetapi, dalam keadaan cair (yaitu, ketika meleleh)
atau dilarutkan dalam air, ion-ion bebas bergerak dan cairan yang dihasilkan
menghantarkan listrik.
Kristal Kovalen
Dalam kristal kovalen, atom diikat bersama dalam jaringan tiga
dimensi yang luas seluruhnya oleh ikatan kovalen. Contoh yang terkenal adalah
dua alotrop karbon: intan dan grafit. Pada intan, setiap atom karbon
dihibridisasi sp³; karbon terikat pada empat atom lain. Ikatan kovalen yang kuat dalam tiga dimensi
berkontribusi pada kekerasan berlian yang tidak biasa (ini adalah bahan
terkeras yang diketahui) dan titik leleh yang sangat tinggi (3550°C). Dalam
grafit, atom karbon tersusun dalam enam cincin beranggota. Atom semuanya
hibridisasi sp²; setiap atom terikat secara kovalen dengan tiga atom lainnya.
Orbital 2p tak terhibridisasi yang tersisa digunakan dalam ikatan pi. Faktanya,
setiap lapisan grafit memiliki orbital molekul yang terdelokalisasi seperti
yang terdapat dalam benzena. Karena elektron bebas bergerak dalam orbital
molekul yang terdelokalisasi secara ekstensif ini, grafit adalah konduktor
listrik yang baik untuk arah di sepanjang bidang atom karbon. Lapisan-lapisan
tersebut disatukan oleh gaya van der Waals yang lemah. Ikatan kovalen dalam
grafit memperhitungkan kekerasannya; namun, karena lapisannya dapat bergeser
satu sama lain, grafit licin saat disentuh dan efektif sebagai pelumas. Ini
juga digunakan pada pensil dan pita yang dibuat untuk printer komputer dan
mesin ketik.
|
|
|
Gambar
11.28 (a) Struktur berlian. Setiap karbon terikat secara tetrahedral
dengan empat atom karbon lainnya. (b) Struktur grafit. Jarak antara
lapisan yang berurutan adalah 335 pm. |
|
|
|
Kuarsa |
Kristal kovalen lainnya adalah kuarsa (SiO₂). Susunan atom silikon dalam kuarsa mirip
dengan karbon pada intan, tetapi dalam kuarsa terdapat atom oksigen di antara
setiap pasangan atom Si. Karena Si dan O memiliki elektronegativitas yang
berbeda, ikatan Si-O bersifat polar. Namun demikian, SiO₂ mirip dengan berlian dalam banyak hal,
seperti kekerasan dan titik leleh tinggi (1610°C).
Kristal Molekul
|
|
|
Sulfur |
Dalam kristal molekul, titik kisi ditempati
oleh molekul, dan gaya tarik di antara keduanya adalah gaya van der Waals
dan/atau ikatan hidrogen. Contoh kristal molekul adalah sulfur dioksida padat
(SO₂), di mana gaya tarik
yang dominan adalah interaksi dipol-dipol. Ikatan hidrogen antarmolekul
terutama bertanggung jawab untuk menjaga kisi es tiga dimensi (lihat Gambar
11.12). Contoh lain dari kristal molekul adalah I₂, P₄, dan S₈.
Secara umum, kecuali dalam es, molekul dalam
kristal molekul dikemas bersama sedekat mungkin dengan ukuran dan bentuknya.
Karena gaya van der Waals dan ikatan hidrogen umumnya cukup lemah dibandingkan
dengan ikatan kovalen dan ionik, kristal molekul lebih mudah dipecah daripada
kristal ionik dan kovalen. Memang, sebagian besar kristal molekul meleleh pada
suhu di bawah 100°C.
Krsital Logam
Dalam arti tertentu, struktur kristal logam
adalah yang paling sederhana karena setiap titik kisi dalam kristal ditempati
oleh atom dari logam yang sama. Kristal logam umumnya berbentuk kubus berpusat
badan, kubus berpusat muka, atau heksagonal. Akibatnya, unsur logam biasanya
sangat padat.
|
|
|
Gambar
11.29 Struktur kristal logam. Logam-logam tersebut ditunjukkan posisinya
di tabel periodik. Mn berstruktur kubus, Ga berstruktur ortorombik, In dan Sn
berstruktur tetragonal, dan Hg berstruktur rombohedral (lihat Gambar 11.15). |
Ikatan pada logam sangat berbeda dengan ikatan
pada jenis kristal lainnya. Dalam logam, elektron ikatan terdelokalisasi di
seluruh kristal. Nyatanya, atom logam dalam kristal dapat dibayangkan sebagai
deretan ion positif yang tenggelam dalam lautan elektron valensi yang
terdelokalisasi. Gaya kohesif besar yang dihasilkan dari delokalisasi
bertanggung jawab atas kekuatan logam. Mobilitas elektron yang terdelokalisasi
membuat logam menjadi konduktor panas dan listrik yang baik.
|
|
|
Gambar 11.30 Penampang
kristal logam. Setiap muatan positif yang dilingkari mewakili inti
dan elektron bagian dalam dari atom logam. Area abu-abu
yang mengelilingi ion logam positif menunjukkan lautan elektron
valensi. |
Tabel 11.4 Jenis Kristal dan Sifat Umumnya
|
Jenis Kristal |
Gaya yang menyatukan |
Sifat Umum |
Contoh |
|
Ionik |
Tarik menarik elektrostatis |
Keras, rapuh, titik leleh tinggi, konduktor
panas dan listrik yang buruk |
NaCl, LiF, MgO, CaCO₃ |
|
Kovalen |
Ikatan kovalen |
Keras, titik leleh tinggi, konduktor panas
dan listrik yang buruk |
C (berlian), SiO₂ (kuarsa) |
|
Molekul |
Gaya disperse, gaya dipol-dipol, ikatan
hidrogen |
Lunak, titik leleh rendah, konduktor panas
dan listrik yang buruk |
Ar, CO₂, I₂, H₂O, C₁₂H₂₂O₁₁ (sukrosa) |
|
Logam |
Ikatan logam |
Lembut hingga keras, titik leleh rendah
hingga tinggi, konduktor panas dan listrik yang baik |
Semua unsur logam; misalnya, Na, Mg, Fe, Cu |
Padatan paling stabil dalam bentuk kristal. Namun, jika zat
padat terbentuk dengan cepat (misalnya, ketika cairan didinginkan dengan
cepat), atom atau molekulnya tidak punya waktu untuk menyelaraskan diri dan
mungkin terkunci pada posisi selain kristal biasa. Padatan yang dihasilkan dikatakan
amorf. Zat padat amorf, seperti kaca, tidak memiliki susunan atom tiga dimensi
yang teratur. Pada bagian ini, kita akan membahas secara singkat tentang
sifat-sifat kaca.
Kaca adalah salah satu bahan peradaban yang
paling berharga dan serbaguna. Ini juga salah satu yang tertua barang kaca yang
berasal dari 1000 SM. Kaca umumnya mengacu pada produk fusi transparan secara
optik dari bahan anorganik yang telah didinginkan ke keadaan kaku tanpa
mengkristal. Yang dimaksud dengan produk fusi adalah bahwa kaca dibentuk dengan
mencampurkan silikon dioksida cair (SiO₂), komponen utamanya, dengan senyawa seperti
natrium oksida (Na₂O), boron oksida (B₂O₃), dan oksida logam transisi tertentu untuk
warna dan sifat lainnya. Dalam beberapa hal, kaca berperilaku lebih seperti
cairan daripada padatan. Studi difraksi sinar-X menunjukkan bahwa kaca tidak
memiliki tatanan periodik jarak jauh.
Ada sekitar 800 jenis kaca yang umum digunakan saat ini. Gambar
11.31 menunjukkan representasi skematik dua dimensi dari kristal kuarsa dan
kaca kuarsa amorf. Tabel 11.5 menunjukkan komposisi dan sifat gelas kuarsa,
Pyrex, dan soda-kapur.
|
|
|
Gambar
11.31 Representasi dua dimensi dari (a) kuarsa kristal dan (b) kaca
kuarsa nonkristalin. Bola kecil mewakili silikon. Pada kenyataannya, struktur
kuarsa memiliki tiga dimensi. Setiap atom Si terikat secara tetrahedral pada
empat atom O. |
Warna kaca sebagian besar disebabkan oleh
keberadaan ion logam (sebagai oksida). Misalnya, gelas hijau mengandung besi
(III) oksida, Fe₂O₃, atau tembaga (II) oksida, CuO; gelas kuning
mengandung uranium (IV) oksida, UO₂; gelas biru mengandung oksida kobalt (II) dan
tembaga (II), CoO dan CuO; dan kaca merah mengandung partikel kecil emas dan
tembaga. Perhatikan bahwa sebagian besar ion yang disebutkan di sini berasal
dari logam transisi.
Tabel 11.5 Komposisi dan Sifat Tiga Jenis Kaca
|
Nama |
Komposisi |
Sifat dan Kegunaan |
|
Kaca Kuarsa Murni |
100% SiO₂ |
Ekspansi termal rendah, transparan untuk
berbagai panjang gelombang. Digunakan dalam penelitian optik. |
|
Kaca Pyrex |
SiO₂ (60-80%), B₂O₃ (10-25%), Al₂O₃
(sedikit) |
Ekspansi termal rendah; transparan untuk
terlihat dan inframerah, tetapi tidak untuk UV, radiasi. Digunakan terutama
di laboratorium dan gelas memasak rumah tangga. |
|
Kaca Soda-Kapur |
SiO₂ (75%), Na₂O (15%), CaO (10%) |
Mudah terserang bahan kimia dan peka
terhadap guncangan termal. Mengirimkan cahaya tampak, tetapi menyerap radiasi
UV. Digunakan terutama di jendela dan botol. |
Perubahan fase adalah perubahan fisik yang
ditandai dengan perubahan keteraturan molekul; molekul dalam fase padat memiliki
keteraturan terbesar, dan molekul dalam fase gas memiliki keacakan terbesar.
Ingatlah bahwa hubungan antara perubahan energi dan kenaikan atau penurunan
orde molekul akan membantu dalam memahami sifat dari perubahan fisika.
Kesetimbangan Uap-Cair
Molekul dalam cairan tidak terikat dalam kisi
yang kaku. Meskipun molekul-molekul cairan tidak memiliki kebebasan total
seperti molekul gas, molekul-molekul ini terus bergerak. Karena cairan lebih
padat daripada gas, laju tumbukan antar molekul jauh lebih tinggi di fase cair
daripada di fase gas. Ketika molekul dalam cairan memiliki energi yang cukup
untuk keluar dari permukaan, perubahan fasa terjadi. Evaporasi, atau penguapan,
adalah proses di mana zat cair diubah menjadi gas.
Bagaimana penguapan bergantung pada suhu?
Gambar 11.32 menunjukkan distribusi energi kinetik molekul dalam cairan pada
dua temperatur berbeda. Seperti yang dapat dilihat, semakin tinggi suhunya,
semakin besar energi kinetiknya, dan karenanya lebih banyak molekul yang
meninggalkan cairan.
|
|
|
Gambar
11.32 Kurva distribusi energi kinetik untuk molekul dalam cairan (a)
pada suhu T₁ dan (b) pada suhu T₂ yang lebih tinggi. Perhatikan bahwa pada
suhu yang lebih tinggi, kurva menjadi rata. Area yang diarsir menunjukkan
jumlah molekul yang memiliki energi kinetik sama dengan atau lebih besar dari
energi kinetik tertentu E₁. Semakin tinggi suhunya, semakin banyak jumlah
molekul dengan energi kinetik yang tinggi. |
Tekanan uap
Saat cairan menguap,
molekul gasnya memberikan tekanan uap. Sebelum proses penguapan dimulai, kadar
merkuri dalam tabung manometer berbentuk U adalah sama. Segera setelah beberapa
molekul meninggalkan cairan, fase uap terbentuk. Tekanan uap hanya dapat diukur
jika terdapat uap dalam jumlah yang cukup. Namun, proses penguapan tidak
berlanjut tanpa batas waktu. Akhirnya, ketinggian merkuri menjadi stabil dan
tidak ada perubahan lebih lanjut yang terlihat.
|
|
|
Gambar
11.33 Alat untuk mengukur tekanan uap cairan. (a) Awalnya cairan
dibekukan sehingga tidak ada molekul dalam fase uap. (b) Pada pemanasan, fase
cair terbentuk dan penguapan dimulai. Pada kesetimbangan, jumlah molekul yang
meninggalkan cairan sama dengan jumlah molekul yang kembali ke cairan.
Perbedaan ketinggian merkuri (h) memberikan tekanan uap kesetimbangan cairan
pada suhu yang ditentukan. |
Apa yang terjadi pada tingkat molekul selama
penguapan? Pada awalnya, lalu lintas hanya satu arah: Molekul bergerak dari zat
cair ke ruang kosong. Segera molekul di ruang di atas cairan membentuk fase
uap. Ketika konsentrasi molekul dalam fase uap meningkat, beberapa molekul
mengembun, yaitu kembali ke fase cair. Kondensasi, perubahan dari fasa gas ke
fasa cair, terjadi karena molekul menabrak permukaan cairan dan terperangkap
oleh gaya antarmolekul dalam cairan.
Laju penguapan konstan pada suhu tertentu, dan laju kondensasi
meningkat seiring dengan peningkatan konsentrasi molekul dalam fase uap.
Keadaan kesetimbangan dinamis, di mana laju proses maju persis seimbang dengan
laju proses balik, tercapai ketika laju kondensasi dan penguapan menjadi sama.
Tekanan uap kesetimbangan adalah tekanan uap yang diukur saat kesetimbangan
dinamis terjadi antara kondensasi dan penguapan. Kita sering menggunakan
istilah yang lebih sederhana "tekanan uap" ketika berbicara tentang
tekanan uap kesetimbangan suatu zat cair. Praktik ini dapat diterima selama
diketahui arti dari istilah yang disingkat ini.
Penting untuk dicatat bahwa tekanan uap
kesetimbangan adalah tekanan uap maksimum suatu zat cair pada suhu tertentu dan
konstan pada suhu konstan. (Ini tidak tergantung pada jumlah cairan selama ada
cairan.) Dari pembahasan sebelumnya kita perkirakan tekanan uap suatu cairan
meningkat seiring peningkatan suhu. Plot tekanan uap terhadap suhu untuk tiga
cairan berbeda pada Gambar 11.35 menegaskan ekspektasi ini.
|
|
|
Gambar
11.35 Kenaikan tekanan uap terhadap suhu untuk tiga cairan. Titik didih
normal zat cair (pada 1 atm) ditunjukkan pada sumbu horizontal. Ikatan logam
yang kuat dalam merkuri menghasilkan tekanan uap cairan yang jauh lebih
rendah pada suhu kamar. |
Kalor Penguapan Molar dan Titik Didih
Ukuran kekuatan gaya antarmolekul dalam cairan adalah kalor
penguapan molar (𝛥Hvap), yang didefinisikan sebagai energi (biasanya
dalam kilojoule) yang dibutuhkan untuk menguapkan 1 mol cairan. Kalor penguapan
molar berhubungan langsung dengan kekuatan gaya antarmolekul yang ada pada zat
cair. Jika tarikan antarmolekul kuat, dibutuhkan banyak energi untuk
membebaskan molekul dari fasa cair dan kalor penguapan molar akan semakin
tinggi. Cairan semacam itu juga akan memiliki tekanan uap yang rendah.
Pembahasan sebelumnya memprediksi bahwa tekanan uap
kesetimbangan (P) suatu zat cair akan meningkat dengan meningkatnya
suhu, seperti yang ditunjukkan pada Gambar 11.35. Analisis perilaku ini
mengungkapkan bahwa hubungan kuantitatif antara tekanan uap P cairan
dan suhu mutlak T diberikan oleh persamaan Clausius -Clapeyron
dimana ln adalah logaritma natural, R adalah konstanta gas
(8,314 J/K.mol), dan C adalah konstanta. Persamaan Clausius-Clapeyron berbentuk
persamaan linier y = mx + b:
Dengan mengukur tekanan uap cairan pada suhu yang berbeda (lihat
Gambar 11.35) dan memplot ln P terhadap 1/T, kita menentukan kemiringan, yang
sama dengan -𝛥Hvap/R. (𝛥Hvap diasumsikan tidak bergantung pada suhu.) Ini adalah metode
yang digunakan untuk menentukan kalor penguapan.
|
|
|
Gambar
11.36 Plot
ln P terhadap 1/T untuk air dan dietil eter. Kemiringan dalam setiap kasus
sama dengan -𝛥Hvap/R,
gambar tersebut menunjukkan
plot ln P terhadap 1/T untuk air dan dietileter. Perhatikan bahwa garis lurus
untuk air memiliki kemiringan yang lebih curam karena air memiliki 𝛥Hvap yang lebih besar. |
Jika kita mengetahui nilai 𝛥Hvap dan P suatu zat cair pada satu
temperatur, maka dapat digunakan persamaan Clausius-Clapeyron untuk menghitung
tekanan uap zat cair pada temperatur yang berbeda. Pada suhu T₁ dan T₂, tekanan uapnya adalah P₁ dan P₂. Dari Persamaan (11.2) dapat ditulis
Mengurangkan Persamaan (11.4) dari Persamaan (11.3) didapatkan
Sehingga,
Contoh 11.7
Dietil eter adalah cairan organik yang mudah menguap dan sangat
mudah terbakar yang digunakan terutama sebagai pelarut. Tekanan uap dietil eter
adalah 401 mmHg pada suhu 18°C. Hitung tekanan uapnya pada 32°C.
Penyelesaian
Tabel 11.6 memberi data bahwa 𝛥Hvap = 26,0 kJ/mol. Datanya
P₁ = 401 mmHg
P₂ = ?
T₁ = 18ºC = 291 K
T₂ = 32ºC = 305 K
Dari Persamaan (11.5) didapatkan
Mengambil antilog dari kedua sisi (lihat Lampiran 4), diperoleh
sehingga,
P₂ = 656 mmHg
Cara praktis untuk mendemonstrasikan kalor molar penguapan
adalah dengan menggosokkan alkohol seperti etanol (C₂H₅OH) atau isopropanol (C₃H₇OH), atau alkohol gosok, pada telapak tangan.
Alkohol ini memiliki 𝛥Hvap yang lebih
rendah daripada air, sehingga kalor dari tangan cukup untuk meningkatkan energi
kinetik molekul alkohol dan menguapkannya. Akibat hilangnya kalor, tangan akan
terasa dingin. Proses ini mirip dengan keringat, yang merupakan salah satu cara
tubuh manusia mempertahankan suhu yang konstan. Karena ikatan hidrogen
antarmolekul yang kuat yang ada di air, sejumlah besar energi diperlukan untuk
menguapkan air dalam keringat dari permukaan tubuh. Energi ini dipasok oleh
kalor yang dihasilkan dalam berbagai proses metabolisme.
Telah ditunjukkan bahwa tekanan uap suatu zat
cair meningkat seiring dengan peningkatan suhu. Setiap cairan memiliki suhu di
mana ia mulai mendidih. Titik didih adalah suhu di mana tekanan uap suatu zat
cair sama dengan tekanan eksternal. Titik didih normal suatu zat cair adalah
suhu di mana zat itu mendidih ketika tekanan luar adalah 1 atm.
Pada titik didih, gelembung terbentuk di dalam cairan. Ketika
gelembung terbentuk, cairan yang menempati ruang itu terdorong ke samping, dan
ketinggian cairan di dalam wadah dipaksa naik. Tekanan yang diberikan pada
gelembung sebagian besar adalah tekanan atmosfer, ditambah beberapa tekanan
hidrostatik (yaitu, tekanan karena adanya cairan). Tekanan di dalam gelembung
hanya disebabkan oleh tekanan uap cairan. Ketika tekanan uap menjadi sama
dengan tekanan eksternal, gelembung naik ke permukaan cairan dan meledak. Jika
tekanan uap dalam gelembung lebih rendah dari tekanan eksternal, gelembung
tersebut akan pecah sebelum bisa naik. Dengan demikian kita dapat menyimpulkan
bahwa titik didih suatu zat cair bergantung pada tekanan luar. (Biasanya dapat
diabaikan kontribusi kecil karena tekanan hidrostatik.) Misalnya, pada 1 atm,
air mendidih pada 100°C, tetapi jika tekanan dikurangi menjadi 0,5 atm, air
mendidih hanya pada 82°C.
Karena titik didih ditentukan dalam istilah tekanan uap cairan,
maka titik didih diharapkan terkait dengan kalor molar penguapan: Semakin
tinggi 𝛥Hvap, semakin tinggi titik didihnya. Data pada
Tabel 11.6 secara kasar mengkonfirmasi prediksi ini. Pada akhirnya, baik titik
didih maupun 𝛥Hvap ditentukan oleh kekuatan gaya
antarmolekul. Misalnya, argon (Ar) dan metana (CH₄), yang memiliki gaya dispersi lemah, memiliki
titik didih rendah dan kalor penguapan molar kecil. Dietil eter (C₂H₅OC₂H₅) memiliki momen dipol, dan gaya dipol-dipol
menyebabkan titik didih dan 𝛥Hvapnya cukup tinggi. Baik etanol (C₂H₅OH) dan air memiliki ikatan hidrogen yang
kuat, yang menyebabkan titik didihnya yang tinggi dan nilai 𝛥Hvap yang besar. Ikatan logam yang kuat menyebabkan merkuri
memiliki titik didih dan 𝛥Hvap tertinggi dari
kelompok cairan ini. Menariknya, titik didih benzena, yang nonpolar, sebanding
dengan titik didih etanol. Benzene memiliki polarisasi tinggi karena distribusi
elektronnya di orbital molekul pi yang terdelokalisasi, dan gaya dispersi di
antara molekul benzena bisa sekuat atau bahkan lebih kuat dari gaya dipol-dipol
dan/atau ikatan hidrogen.
Suhu dan Tekanan Kritis
Kebalikan dari penguapan adalah kondensasi.
Pada prinsipnya, gas dapat dicairkan dengan salah satu dari dua teknik. Dengan
mendinginkan sampel gas, dapat dikurangi energi kinetik molekulnya, sehingga
akhirnya molekul berkumpul untuk membentuk tetesan kecil cairan. Alternatifnya,
dapat diberi tekanan pada gas. Kompresi mengurangi jarak rata-rata antar
molekul sehingga mereka terikat oleh daya tarik timbal balik. Proses pencairan
pada industri menggabungkan dua metode ini.
Setiap zat memiliki suhu kritis (Tc), di atasnya fase
gasnya tidak dapat dicairkan, tidak peduli seberapa besar tekanan yang
diberikan. Ini juga merupakan suhu tertinggi di mana suatu zat dapat eksis
sebagai cairan. Dengan kata lain, di atas suhu kritis tidak ada perbedaan
mendasar antara cairan dan gas — kita hanya memiliki fluida. Tekanan kritis (Pc)
adalah tekanan minimum yang harus diterapkan untuk menghasilkan likuifaksi pada
suhu kritis. Adanya temperatur kritis secara kualitatif dapat dijelaskan
sebagai berikut. Gaya tarik antarmolekul adalah kuantitas terbatas untuk zat
tertentu dan tidak bergantung pada suhu. Di bawah Tc, gaya ini
cukup kuat untuk menahan molekul bersama-sama (di bawah tekanan yang sesuai)
dalam cairan. Di atas Tc, gerakan molekul menjadi sangat energik
sehingga molekul dapat melepaskan diri dari tarikan ini. Gambar 11.37
menunjukkan apa yang terjadi jika sulfur heksafluorida dipanaskan di atas suhu
kritisnya (45,5°C) dan kemudian didinginkan hingga di bawah 45,5°C.
|
|
|
Gambar
11.37 Fenomena kritis belerang heksafluorida. (a) Di bawah suhu kritis
fasa cairan bening terlihat. (b) Di atas suhu kritis, fase cair telah
menghilang. (c) Zat didinginkan tepat di bawah suhu kritisnya. Kabut mewakili
kondensasi uap. (d) Akhirnya, fase cair muncul kembali. |
Tabel 11.7 mencantumkan suhu kritis dan
tekanan kritis dari sejumlah zat yang umum dijumpai. Suhu kritis suatu zat
mencerminkan kekuatan gaya antarmolekulnya. Benzena, etanol, merkuri, dan air,
yang memiliki gaya antarmolekul yang kuat, juga memiliki suhu kritis yang
tinggi dibandingkan dengan zat lain yang tercantum dalam tabel.
Kesetimbangan
Cair-Padat
Transformasi dari cairan menjadi padat disebut pembekuan, dan
proses sebaliknya disebut peleburan, atau mencair. Titik leleh zat padat atau
titik beku zat cair adalah suhu di mana fase padat dan cair berada bersama
dalam kesetimbangan. Titik leleh (atau beku) normal suatu zat adalah suhu di
mana zat meleleh (atau membeku) pada tekanan 1 atm. Biasanya dihilangkan kata
"normal" saat tekanan berada di 1 atm.
Kesetimbangan cair-padat yang paling dikenal adalah air dan es. Pada 0°C dan 1
atm, kesetimbangan dinamis diwakili oleh
H₂O(s)
⇋
H₂O(l)
Ilustrasi praktis
kesetimbangan dinamis ini disediakan oleh segelas air es. Saat es batu meleleh
membentuk air, sebagian air di antara es batu dapat membeku, sehingga keduanya
bergabung. Namun, ini bukan kesetimbangan dinamis yang sebenarnya, karena es
tidak disimpan pada 0°C; dengan demikian, semua es batu pada akhirnya akan
mencair.
Hubungan keseluruhan antara fase padat, cair, dan uap paling
baik disajikan dalam satu grafik yang dikenal sebagai diagram fase. Diagram
fase meringkas kondisi di mana suatu zat ada sebagai padatan, cairan, atau gas.
Pada bagian ini kita akan membahas secara singkat diagram fase air dan karbon
dioksida.
4.Simulasi Rangkaian
A. Prosedur Percobaan





































































Tidak ada komentar:
Posting Komentar