Latihan 8
Chapter 24
1. Berikut rumus molekul dari aldehid (alkanal) yang benar adalah…
a. CnH2O
b. CnH2nO2
e. CnHnO2
c. CnH2nO
d. CnH2nO2n
Jawaban : D
Pembahasan :
Karena jumlah atom hidrogen dalam aldehid adalah dua kali jumlah atom karbonnya, salah satu atom carbon dalam aldehid mempunyai ikatan ganda dengan oksigen.
2. Aldehid dan keton memiliki gugus fungsi yang sama, yaitu…
a. gugus hidroksil
b. gugus karbinol
c. gugus karboksil
d. gugus karbonil
e. gugus amina
Jawaban: D
Pembahasan:
- Gugus karbonil adalah gugus dimana ikatan atom C rangkap dua terhadap atom O atau (C=O)
- Gugus karbinol adalah gugus dimana ikatan atom C tunggal terhadap atom O atau (C-O)
- Gugus hidroksil adalah gugus dimana ikatan atom O dan H atau (-OH)
- Gugus karboksil yaitu COO-
- Gugus amina yaitu -NH2
3. Alkil halida dapat dibuat dari suatu alkena melalui reaksi…
a. subtitusi
b. adisi
c. eliminasi
d. polimerisasi
e. kondensasi
Jawaban : C
Pembahasan
Produk reaksi eliminasi adalah alkena. Reaksi eliminasi dapat diperoleh dengan mereaksikan alkil halida dengan basa kuat. Pada reaksi ini terjadi kehilangan atom-atom atau ion-ion dari dalam strukturnya
4. Haloalkana yang digunakan sebagai antiseptik pada luka adalah…
a. CHCl3
b. CHI3
c. C2H5Cl
d. CCl4
e. CHCl=CH2
Jawaban : B
Pembahasan :
CHI3 (iodoform) merupakan suatu zat berwarna kuning, berbau khas dan digunakan sebagai antiseptik
CHCl3 (kloroform) pernah digunakan secara luas sebagai zat anatesi, tetapi kini sudah ditinggalkan karena menyebabkan kerusakan hati
C2H5Cl (kloroetana) digunakan sebagai bahan anastesi lokal
CCl4 (tetraklorometana) digunakan sebagai pelarut untuk oli dan lemak serta dalam pencucian kering.
Kuis 8
Chapter 13
1. Suatu reaksi kimia yang berlangsung pada suhu 30°C memerlukan waktu 40 detik. Setiap kenaikan suhu 10°C, reaksi akan lebih cepat dua kali dari semula. berapakah waktu yang diperlukan jika suhu dinaikkan menjadi 50°C…
a. 30 detik
b. 20 detik
c. 15 detik
d. 10 detik
e. 5 detik
Jawaban : D
Pembahasan :
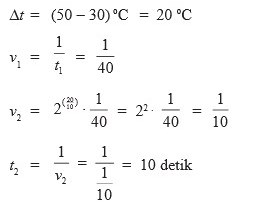
2. Dalam suatu reaksi kimia, setiap kenaikan suhu 10°C reaksi menjadi dua kali lebih cepat. Beberapa kali lebih cepat reaksi pada 80° C dibandingkan pada suhu 20°
a. 8 kali
b. 16 kali
c. 32 kali
d. 64 kali
e. 128 kali
Jawaban : D
Pembahasan :
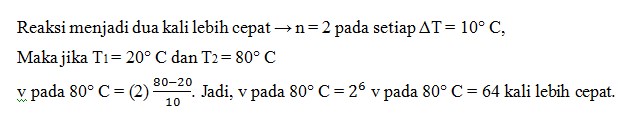
Chapter 14
1. Pada suhu tertentu 0,350 g BaF2 (Mr = 175) melarut dalam air murni membentuk 1 liter larutan jenuh. Hasil kali kelarutan BaF2 pada suhu itu adalah…
a. 1,7 x 10-2
b. 3,2 x 10-6
c. 3,2 x 10-8
d. 3,2 x 10-9
e. 4,0 x 10-9
Jawaban : C
Pembahasan:
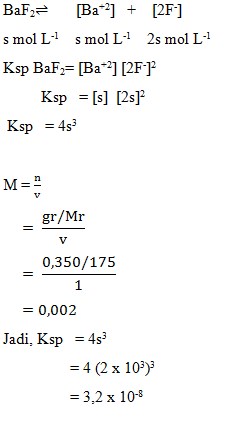
2. Bila kelarutan barium fosfat, Ba3(PO4)2, ialah x mol L-1, maka Ksp zat itu adalah…
a. x2
b. 4x3
c. 27x4
d. 27x
e. 108x5
Jawaban : E
Pembahasan:
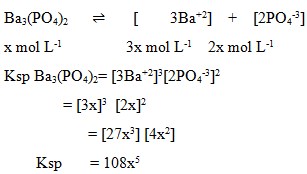
Chapter 15
1. Larutan asam lemah NH4OH 0,1 M,dan Kb = 10-5 , nilai pH larutan tersebut adalah… . .
a. 11
b. 3
c. 9
d. 14
e. 6
Jawaban : A
Pembahasan:
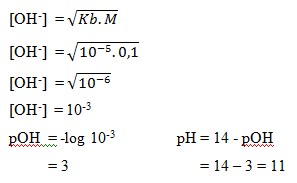
2. Menurut konsep asam-basa Bronsted-Lowry dalam reaksi
NH3 + H2O → NH4+ + OH–
Dapat ditarik kesimpulan…..
a. Air adalah asam karena dapat menerima sebuah proton
b. Amonia dan air adalah pasangan asam-basa konjugat
c. NH3 dan NH4+ adalah pasangan asam-basa konjugat
d. NH3 adalah asam karena memberi sebuah proton
e. NH4+ dan OH– adalah basa kuat
Jawaban : C
Pembahasan:
Asam adalah suatu spesies kimia (molekul atau ion) yang dapat mendonorkan suatu proton kepada spesies kimia yang lain atau dengan kata lain sebagai proton donor.
Basa adalah suatu spesies kimia (molekul atau ion) yang dapat menerima suatu proton dari spesies kimia yang lain atau dengan kata lain sebagai proton akseptor.
Pernyataan A tidak tepat karena asam menurut Bronsted-Lowry adalah bertindak sebagai donor proton.
Pernyataan B tidak tepat karena pasangan asam basa yaitu NH3 – NH4+ dan H2O – OH–.
Pernyataan D tidak tepat karena yang bertindak sebagai asam adalah H2O.
Pernyataan E tidak tepat karena tidak sesuai dengan konsep asam-basa Menurut Bronsted-Lowry.
Pernyataan yang tepat adalah yang C karena molekul H2O bertindak sebagai asam yang mendonorkan proton ke molekul NH3 sebagai basa. Demikian pula ion NH4+ bertindak sebagai asam yang mendonorkan protonnya ke ion OH– sebagai basa.
Chapter 16
1.Pernyataan yang benar tentang larutan penyangga adalah ….
a. mempertahankan pH sistem agar tetap
b. memiliki komponen asam dan basa yang selalu berupa pasangan konjugasi
c. mampu mengatasi penambahan asam dan basa dalam jumlah banyak
d. memiliki kapasitas tertentu
e. pengenceran tidak mengubah konsentrasi ion H+ dan OH–
Jawaban : A
Pembahasan:
Larutan penyangga atau larutan buffer adalah larutan yang mampu mempertahankan pH pada kisarannya apabila terjadi upaya untuk menaikkan atau menurunkan pH akibat penambahan sedikit asam, sedikit basa, atau pengenceran.
2. Campuran kristal garam berikut yang dapat berperan sebagai larutan penyangga adalah ….
a. NaH2PO4 dan Na2HPO4
b. NaCl dan NH4Cl
c. (NH4)2SO4 dan Na2SO4
d. NaHSO4 dan Na2SO4
e. KNO3 dan NaNO3
(KIMIA SMA XI. Unggul Sudarmo. Phibeta. 2007 .h. 192)
Jawaban : A
Pembahasan :
Prinsip larutan penyangga berdasarkan teori asam basa Arrhenius terbatas hanya untuk campuran asam lemah dan garamnya atau basa lemah dan garamnya, sedangkan prinsip berdasarkan Bronsted-Lowry lebih umum, selain asam lemah dan garamnya juga mencakup campuran garam dan garam.
Sistem kesetimbangan asam lemah dan basa konjugatnya dapat berasal dari garam NaH2PO4 dan Na2HPO4 , jika kedua garam ini dicampurkan akan terbentuk larutan penyangga.
NaH2PO4 (aq) → Na+(aq) + H2PO4–(aq)
Na2HPO4 (aq) → 2Na+(aq) + HPO42-(aq)
Kedua anion tersebut membentuk asam basa konjugat dan berada dalam keadaan kesetimbangan.
Oleh karena ion H2PO4– memiliki tingkat keasaman lebih kuat dibandingkan ion HPO42- maka H2PO4– berperan sebagai asam dan HPO42- sebagai basa konjugatnya. Persamaan reaksinya sebagai berikut.
H2PO4–(aq) ↔ HPO42-(aq) + H+(aq)
Chapter 17
Chapter 18
1. Contoh reaksi oksidasi adalah . . .
a. Ag+ (aq) berubah menjadi Ag (s)
b. Cl2 (g) berubah menjadi Cl‾ (aq)
c. I– (aq) berubah menjadi I2 (s)
d. Cr6+ berubah menjadi CrO4¯²
e. H2O (l) berubah menjadi OH‾ (aq)
Jawaban : C
Pembahasan :
Oksidasi yaitu dimana bertambahnya bilangan oksidasi
Maka unsur di atas yang mengalami oksidasi adalah :
I‾ (aq) berubah menjadi I2 (s)
Dikarenakan I‾ = -1 menjadi I2 = 0
Sedangkan :
- Ag+ = +1 menjadi Ag = 0 reduksi
- Cl2 = 0 menjadi Cl‾¹ = -1 reduksi
- Cr+6 = +6 menjadi CrO4²‾ = 6 tidak terjadi reduksi maupun oksidasi
- H2O = +1 menjadi OH‾ = -1 reduksi
2. Reaksi Redoks :
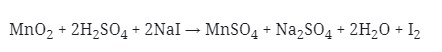
Yang berperan sebagai oksidator pada reaksi di atas adalah . . .
a. NaI
b. H2SO4
c. Mn2+
d. I–
e. MnO2
Jawaban : E
Pembahasan :
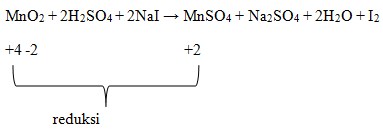
Diketahui bahwa oksidator yang mengalami reduksi atau penurunan biloks.
Dimana dilihat bahwa Mn pada MnO2 adalah +4.
Biloks Mn pad MnSO4 adalah +2.
Terjadi penurunan biloks, sehingga MnO2 menjadi oksidator.

Tidak ada komentar:
Posting Komentar