LATIHAN 2
Chapter 1
Massa jenis merkuri, satu-satunya logam yang berbentuk cair pada suhu kamar, adalah 13,6 g / mL.
Hitung massa 5,50 mL cairan.
Jawab :
Chapter 2
Beri nama senyawa berikut:
Strategi
Perhatikan bahwa senyawa dalam (a) dan (b) mengandung atom-atom logam dan non logam, jadi senyawanya merupakan senyawa ionik. Tidak ada atom logam dalam (c) tetapi ada gugus amonium, yang mengandung muatan positif. Jadi NH4ClO3 juga merupakan senyawa ionik. Referensi untuk nama kation dan anion ada di Tabel 2.3. Perlu diingat bahwa atom logam dapat membentuk kation dengan muatan yang berbeda (lihat Gambar 2.11), kita perlu menggunakan sistem Stock.
Solusi
(a) Ion nitrat (NO3-) mengandung satu muatan negatif, sehingga ion tembaga harus memiliki dua muatan positif. Karena tembaga dapat membentuk ion Cu+ dan Cu2+, kita perlu menggunakan sistem Stock dan memberi nama senyawa tembaga (II) nitrat.
(b) Kationnya adalah K+ dan anionnya adalah H2PO42- (dihidrogen fosfat). Karena kalium hanya membentuk satu jenis ion (K+), tidak perlu menggunakan kalium (I) dalam nama. Senyawa ini adalah kalium dihidrogen fosfat.
(c) Kationnya adalah NH4+ (ion amonium) dan anionnya adalah ClO3-. Senyawa tersebut adalah amonium klorat.
Chapter 3
3.1 Jika diketahui massa atom unsur Fe = 55,847 sma dan massa 1 atom C-12 = 12,000 sma. Hitunglah massa atom relatif Fe ?
Pembahasan
Ar X =
massa rata-rata 1 atom X1/12 x massa 1 atom 12C
Ar Fe =
55,847 sma1/12 x 12,00 sma
= 55,847
3.2 Suatu minuman mengandung alkohol (C2H5OH) sebanyak 0,5 mol.
a. Berapa jumlah molekul C2H5OH?
b. Berapa jumlah atom C, H dan O masing-masing?
c. Berapa jumlah atom total dalam C2H5OH?
Jawab
a. Jumlah molekul C2H5OH?
P (C2H5OH) = N (C2H5OH) × L
P (C2H5OH) = 0,5 mol × 6,02 × 1023 molekul/mol
P (C2H5OH) = 3,01 × 1023 molekul
Jadi, jumlah molekul C2H5OH adalah 3,01 × 1023 molekul
b. Jumlah atom C, H dan O
Dalam C2H5OH terdapat 2 atom C, 6 atom H dan 1 atom O, sehingga jumlah atom masing-masing unsur adalah sebagai berikut.
P (C) = 2 × P (C2H5OH) = 2 × 3,01 × 1023 = 6,02 × 1023 atom
P (H) = 6 × P (C2H5OH) = 6 × 3,01 × 1023 = 1,806 × 1024 atom
P (O) = 1 × P (C2H5OH) = 1 × 3,01 × 1023 = 3,01 × 1023 atom
Jadi,
Jumlah atom C = 6,02 × 1023 atom
Jumlah atom H = 1,806 × 1024 atom
Jumlah atom H = 3,01 × 1023 atom
c. Jumlah atom total dalam C2H5OH
PTotal = P (C) + P (H) + P (O)
PTotal = 6,02 × 1023 + 18,06 × 1023 + 3,01 × 1023
PTotal = 27,09 × 1023
PTotal = 2,709 × 1024 atom
3.6 Sejumlah hidrokarbon dengan volume 20 ml pada keadaan STP dibakar menjadi 60 ml karbon dioksida dan 60 ml air dalam fasa gas dan STP. Apabila diketahui Mr senyawa tersebut sebesar 42, tentukan rumus molekul senyawa hidrokarbon tersebut!
PEMBAHASAN:
Dengan menggunakan hukum avogadro yang menyatakan pada keadaan STP, V1 / n1 = V2 / n2 , maka perbandingan volume sama dengan perbandingan mol. Terdapat dua cara untuk mengerjakan soal tersebut.
Cara : dihitung dari mol CO2 dan H2O
Misal:
V1 = volume CO2
V2 = volume H2O
n1 = mol CO2
n2 = mol H2O
Reaksi yang terjadi yaitu CxHy + O2 à x CO2 + ½ y H2O
Jumlah C pada CO2 adalah 1
Jumlah H pada H2O adalah 2
V1 : V2 = n1 : n2 = 60 :60
CO2 : H2O = 60 : 60
C : H = 60 : 60×2 = 60 : 120 = 1 : 2
Maka rumus empirisnya CH2.
n = 42 / 14 = 3
sehingga rumus molekulnya yaitu (CH2)3 = C3H6
Chapter 4
4.5 Tentukan molaritas dari larutan yang terdiri atas 17,1 gram gula pasir (C12H22O11) dalam 0,25 liter larutan.
Jawab:
Diketahui:
massa = 17,1 gr
Mr. C12H22O11 = 342 gr/mol
V = 0,25 L
Ditanyakan: M = ?
Penyelesaian:
Jumlah mol C12H22O11 = massa/Mr
Jumlah mol C12H22O11 = 17,1 gr /(342 gr/mol)
Jumlah mol C12H22O11 = 0,05 mol
M = jumlah mol/V
M = 0,05 mol/0,25 L
M = 0,2 mol/L
4.7 Sebanyak 20 ml sampel mengandung NaOH dititrasi dengan HCl 0,1 M. Volume titran yang dibutuhkan untuk mencapai titik ekuivalen yaitu sebanyak 18 ml. Berapakah konsentrasi NaOH dalam sampel tersebut?
Penyelesaian
Diketahui:
VNaOH = 20 ml
VHCl = 18 ml
MHCl = 0,1 M
Ditanya: MNaOH
Jawab:
MHCl x VHCl = MNaOH x VNaOH
0,1 M x 18 ml = MNaOH x 20 ml
MNaOH = 0,1 M x 18 ml / 20 ml
= 0,09 M
4.8 Apa prinsip kerja titrasi redoks?
Jawab : Reaksi oksidasi reduksi atau reaksi redoks adalah reaksi yang melibatkan penangkapan dan pelepasan elektron. Dalam setiap reaksi redoks, jumlah elektron yang dilepaskan oleh reduktor harus sama dengan jumlah elektron yang ditangkap oleh oksidator. Ada dua cara untuk menyetarakan persamaan reaksi redoks yaitu metode bilangan oksidasi dan metode setengah reaksi (metode ion elektron). Hubungan reaksi redoks dan perubahan energi adalah sebagai berikut: Reaksi redoks melibatkan perpindahan elektron; Arus listrik adalah perpindahan elektron; Reaksi redoks dapat menghasilkan arus listrik, contoh: sel galvani; Arus listrik dapat menghasilkan reaksi redoks.
Chapter 5
5.5 Hitung volume O₂ (dalam liter) yang dibutuhkan untuk pembakaran total 7,64 L asetilena (C₂H₂) yang diukur pada suhu dan tekanan yang sama.
2C₂H₂(g) + 5O₂(g) → 4CO₂(g) + 2H₂O(l)
2 mol 5 mol
Strategi
Perhatikan bahwa suhu dan tekanan O₂ dan C₂H₂ adalah sama. Hukum gas mana yang diperlukan untuk menghubungkan volume gas dengan mol gas?
Penyelesaian
Menurut hukum Avogadro, pada suhu dan tekanan yang sama, jumlah mol gas secara langsung berkaitan dengan volumenya. Dari persamaan, ada 5 mol O₂ ∞ 2 mol C₂H₂; oleh karena itu, dapat ditulis 5 L O₂ ∞ 2 L C₂H₂. Volume O₂ yang akan bereaksi dengan 7,64 L C₂H₂ diberikan oleh
5.6 Gas oksigen yang dihasilkan dari penguraian kalium klorat dikumpulkan seperti yang ditunjukkan pada Gambar 5.15. Volume oksigen yang dikumpulkan pada 24°C dan tekanan atmosfer 762 mmHg adalah 128 mL. Hitung massa (dalam gram) gas oksigen yang diperoleh. Tekanan uap air pada 24°C adalah 22,4 mmHg.
Strategi
Untuk menyelesaikan massa O₂ yang dihasilkan, pertama-tama harus dihitung tekanan parsial O₂ dalam campuran. Hukum gas apa yang dibutuhkan? Bagaimana mengubah tekanan gas O₂ menjadi massa O₂ dalam gram?
Penyelesaian
Dari hukum Dalton tentang tekanan parsial, diketahui bahwa
PT = PO₂ + PH₂O
Sehingga
PO₂ = PT ₋ PH₂O
= 762 mmHg - 22,4 mmHg
= 740 mmHg
Dari persamaan gas ideal dapat dituliskan
di mana m dan ℳ masing-masing adalah massa O₂ yang dikumpulkan dan massa molar O₂. Dengan menyusun ulang persamaan didapatkan
5.7 Hitung akar rata-rata kuadrat kecepatan dari atom helium dan molekul nitrogen dalam m/s pada 25°C.
Strategi
Untuk menghitung akar-rata-rata-kuadrat kecepatan diperlukan Persamaan (5.16). Satuan apa yang harus digunakan untuk R dan ℳ supaya 𝒗rms diekspresikan dalam m/s?
Penyelesaian
Untuk menghitung 𝒗rms, satuan R harus 8,314 J/K⠂mol dan, karena 1 J = 1 kg m²/s², massa molar harus dalam kg/mol. Massa molar He adalah 4,003 g/mol, atau 4,003 x 10⁻³ kg/mol. Dari persamaan (5.16),
Menggunakan faktor konversi 1 J = 1 kg m²/s² didapatkan
Prosedurnya sama untuk N₂, massa molar adalah 28,02 g/mol, atau 2,802 x 10⁻² kg/mol sehingga dapat dituliskan
5.8 Mengingat bahwa 3,50 mol NH₃ menempati 5,20 L pada 47°C, hitung tekanan gas (dalam atm) menggunakan (a) persamaan gas ideal dan (b) persamaan van der Waals.
Strategi
Untuk menghitung tekanan NH₃ menggunakan persamaan gas ideal, kita melanjutkan seperti pada Contoh 5.3. Koreksi apa yang dibuat untuk faktor tekanan dan volume dalam persamaan van der Waals?
Penyelesaian
(a) Kita memiliki data berikut:
V = 5,20 L
T = (47 + 273) K = 320 K
n = 3,50 mol
R = 0,0821 L . atm/K . mol
Dengan mensubstitusi nilai-nilai ini ke dalam persamaan gas ideal, kita mendapatkan
(b) Kita perlu Persamaan (5.18). Lebih mudah untuk pertama kali menghitung faktor koreksi dalam Persamaan (5.18) secara terpisah. Dari Tabel 5.4, kita memiliki
a = 4,17 atm . L²/mol²
b = 0,0371 L/mol
sehingga faktor koreksi untuk tekanan dan volume adalah
Akhirnya, dengan mensubstitusi nilai-nilai ini ke dalam persamaan van der Waals, kita mendapatkan
(P + 1,89 atm)(5,20 L - 0,130 L) = (3,50 mol)(0,0821 L.atm/K.mol)(320 K)
P = 16,2 atm
Chapter 6
Reaksi termit melibatkan aluminium dan besi (III) oksida
2Al(s) + Fe₂O₃(s) → Al₂O₃(s) + 2Fe(l)
Reaksi ini sangat eksoterm dan besi cair yang terbentuk digunakan untuk logam las. Hitunglah kalor yang dilepaskan dalam kilojoule per gram dari Al yang bereaksi dengan Fe₂O₃. ΔHfº untuk Fe(l) adalah 12,40 kJ/mol.
Strategi
Entalpi reaksi adalah perbedaan antara jumlah dari entalpi produk dan jumlah entalpi reaktan. Entalpi setiap spesi (reaktan atau produk) yang diberikan oleh koefisien stoikiometrinya kali entalpi pembentukan standar spesi.
Penyelesaian
Menggunakan nilai ΔHºf yang diberikan untuk Fe(l) dan nilai ΔHºf lainnya pada Data Termodinamika dan Persamaan (6.18), dapat ditulis
ΔHorx = [ΔHof (Al2O3) + 2ΔHof (Fe)] - [2ΔHof (Al) + ΔHof (Fe2O3)]
= [(-1669,8 kJ/mol) + 2(12,40 kJ/mol)] - [2(0) + (-822,2 kJ/mol)]
= -822,8 kJ/mol
Ini adalah jumlah kalor yang dilepaskan untuk dua mol Al yang bereaksi. Dapat digunakan rasio berikut
untuk mengkonversi menjadi kJ/g Al. Massa molar Al adalah 26,98 g, sehingga
kalor yang dilepas per gram Al = (-822,8kJ/2 mol Al) x (1mol Al/26,98 g Al)
= -15,25 kJ/g
KUIS 2
1. Silicon tetraklorida (SiCl4) dapat dibuat melalui pemanasan Si dalam gas klorin:
Si(s) + 2Cl2(g) --> SiCl4(l)
Dalam suatu reaksi, 0,507 mol SiCl4 dihasilkan. Berapakah mol gas klorin yang digunakan dalam reaksi tersebut?
Pembahasan :
Mol gas klorin yang dibutuhkan dalam reaksi : Si (s) + 2Cl₂ (g) ⇒ SiCl₄ (l) apabila terdapat 0,507 gram SiCl₄ adalah 1,014 mol.
Diketahui : mol Cl₂ = 0,507 mol
reaksi : Si (s) + 2Cl₂ (g) ⇒ SiCl₄ (l)
Ditanya : mol Cl₂ ?
Jawab :
Gunakan perbandingan koefisien untuk menghitung mol :
mol Cl₂ = Koefisien Cl₂ / Koefisien SiCl₄ × mol SiCl₄
= 2/1 × 0,507 mol
= 1,014 mol
∴ Kesimpulan mol Cl₂ yang diperlukan adalah sebanyak 1,014 mol.
2. Nitrogen oksida (NO) bereaksi dengan gas oksigen menghasilkan nitrogen dioksida (NO2), suatu gas yang berwarna coklat tua. Dalam suatu percobaan, 0,886 mol NO dicampur dengan 0,503 mol O2. Tentukan dari kedua gas tersebut mana yang merupakan pereaksi pembatas. Dan tentukan juga jumlah mol NO2 yang dihasilkan.
Pembahasan :
Diketahui : mol O₂ = 0,503 mol
mol NO = 0,886 mol
Ditanya : zat pereaksi pembatas ?
Jawab :
reaksi : 2NO + O₂ ⇒ 2NO₂
mula mula : 0,886 mol 0,503 mol
bereaksi : 0,886 mol 0,443 mol 0,886 mol
_________________________________________ _
sisa : - 0,06 mol 0,886 mol
Pereaksi pembatas adalah zat yang habis bereaksi. maka zatnya adalah NO.
Jumlah mol 2 NO2 yang dihasilkan adalah 0,886 mol. Jadi untuk 1 NO2 maka jumlah molnya adalah 0,886 : 2 = 0,443 mol
3.Etilena (CH) adalah bahan kimia organik yang sangatpenting dalam industri. Etilena dibuat dari pemanasan heksana (CH) pada suhu 800°C:
C6H14 → C2H4 + zat lain
Jika persen hasil dari produksi etilena adalah 42,5 persen, berapa massa heksana yang digunakan dalam reaksi untuk menghasilkan 481 g etilena?
Pembahasan:
Etilena termasuk ke dalam alkena dengan rumus molekul :C₂H₄
Rumus strukturnya : CH₂=CH₂
Etilen pada suhu kamar berbentuk gas
Diketahui
Pembuatan etilena
Ditanya
massa heksana
Jawab
Persen hasil merupakan prosentase dari perbandingan terhadap prosentase secara teoretis dari persamaan reaksi
% hasil = massa hasil / massa teoritis x 100%
Reaksi :
C₆H₁₄ ----> C₂H₄ + zat lain
Mr heksana = 6.12 + 14.1 = 86
Mr etilena = 2.12 + 4.1 = 28
massa teoritisnya adalah : 481 gram /42.5% = 11317,6 gram
mol etilena dari 11317.6 gr :
mol etilena = gram : Mr
mol etilena = 11317.6 : 28 = 404.2 mol
sesuai persamaan reaksi mol heksana : mol etilena = 1 : 1
sehingga mol heksana = 404.2 mol
massa heksana menjadi : 404.2 x 86 = 34761.2 gram
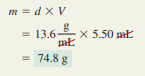








Tidak ada komentar:
Posting Komentar