Latihan 6
Chapter 13
Berdasarkan reasi : 2N2O5(g) → 4 NO2(g) + O2(g), diketahui bahwa N2O5 berkurang dari 2 mol/liter menjadi 0,5 mol/liter dalam waktu 10 detik. Berapakah laju reaksi berkurangnya N2O5 ?
Penyelesaian
vN2O5 = Δ[N2O5]Δt
vN2O5 = 2-0,510 = 0,15 M/detik
Chapter 14
Tuliskan persamaan tetapan kesetimbangan untuk reaksi-reaksi berikut!
a. Fe3+(aq) + SCN–(aq) ↔ FeSCN3+(aq)
b. 3Fe(s) + 4H2O(g) ↔ Fe3O4(s) + 4H2(g)
c. CH3COO-(aq) + H2O(ℓ) ↔ CH3COOH(aq) + OH-(aq)
Pembahasan:

Chapter 15
Chapter 16
Jika kelarutan Ag2CrO4 dalam air adalah 5mol/Liter , tentukan hasil kali kelarutan Ag2CrO4 !
- Jawab :
Ag2CrO4 ⇔ 2Ag+(aq) + CrO4-2(aq)
s 2s s
Ksp Ag2CrO4 = [Ag+]2 . [CrO2-]
Ksp Ag2CrO4 = (2s)2 . (s)
Ksp Ag2CrO4 = 4s3 = 4 x (5)3 = 500
Chapter 17
Suatu gas argon dengan tekanan 1 atm pada suhu ruang memiliki volume awal 500 cm, pada pendinginan hingga suhu -25 volumenya berubah menjadi 50 cm. Berdasarkan data tersebut, tentukan nilai perubahan entropi dari gas argon tersebut.
Chapter 18
Suatu sel volta tersusun dari elektroda magnesium dan tembaga. Jika diketahui:
Mg2+(aq) + 2e– → Mg(s) E = -2,37 volt
Cu2+(aq) + 2e– → Cu(s) E = +0,34 volt
Tentukanlah!
a. katoda dan anoda
b. reaksi yang terjadi pada elektroda dan reaksi selnya
c. notasi sel
d. potensial sel
Pembahasan:
a. Katoda = Cu, karena E besar. Anoda = Mg, karena E kecil.
b. Katoda (reduksi): Cu2+ + 2e– → Cu(s)
Anoda (oksidasi): Mg(s) → Mg2+(aq) + 2e–
_____________________________+
Cu2+(aq) + Mg(s) → Cu(s) + Mg2+(aq)
c. Notasi sel = Mg | Mg2+ || Cu2+ | Cu
d. Potensial sel
Esel = Ekatoda – Eanoda
Esel = 0,34 – (-2,37) = 2,71 volt
Kuis 6
Chapter 13
Penyelesaian
Untuk NO2-, kita bandingkan data 1 terhadap data 2 :
Order NO2- =
Untuk NH4+, kita bandingkan data 4 terhadap data 5 :
Orde NH4+ =
Dengan demikian rumus kecepatan reaksinya adalah = r = k[ NO2-][NH4+]
Chapter 14
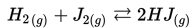
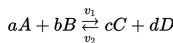
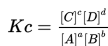
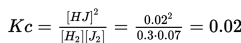
Chapter 15
Jika larutan asam asetat mempunyai pH = 3 dan Ka = 10–5 (Mr = 60), maka jumlah asam asetat dalam 1 liter larutan asam asetat sebesar … .
Pembahasan :
Dik : pH asam asetat = 3
Ka = 10–5 (Mr = 60)
V asam asetat = 1000 mL
Dit : massa asam asetat = …?
Dij :
Asam (pH < 7) konversikan pH menjadi H+ pH = 3 H+ = 10-3 rumus untuk asam lemah H+ = (Ma = molaritas asam) 10-3 = akar (10-5 x Ma) 10-6 = 10-5 x Ma Ma = 10-1 = 0,1 M V = 1 Liter = 1000 mL Ma = massa / Mr x 1000/ V 0,1 = massa/ 60 x 1000/1000 massa = 6 gram
Chapter 16
Diketahui Ksp Ca(OH)2 = 4 x 10-6. Tentukan kelarutan molar Ca(OH)2 dalam air !
Jawab :
Ca(OH)2 ⇔ Ca2+ + 2OH-
maka Ca(OH)2 : senyawa terner (Ksp = 4s3)
s = 3√(Ksp Ca(OH)2/4) = 3√(4 x 10-6/4) = 10-2 M
Chapter 17
Diketahui sebanyak 1 mol air (HO) memiliki suhu 100 dengan kalor 40,7 J/mol. Hitunglah nilai perubahan entropi untuk proses penguapan air tersebut.
Chapter 18
Elektrolisis larutan MnSO4 menggunakan elektroda emas menghasilkan . .
Pembahasan :
MnSO4 → Mn+2 + SO4-2
Katoda = Mn+2 = yang mengalami reduksi adalah air
Anoda = SO4-2 = yang mengalami oksidasi adalah air
Reaksi
Katoda : 2H2O + 2e– → H2 + 2OH- = dihasilkan gas H2
Anoda : 2H2O → 4H+ + O2 + 4e- = dihasilkan gas O2

Tidak ada komentar:
Posting Komentar